Avancées en prévention du VIH et des IST
Cette plénière est consacrée aux travaux les plus discutés actuellement en matière de prévention du VIH mais aussi des IST. En introduction, Edwina WRIGHT, The Alfred Hospital, Australia, rappelle que face à une situation épidémiologique mondiale qui reste élevée, de nouvelles approches sont expérimentées pour apporter de nouveaux outils à la palette déjà existante. C’est l’objet des présentations de cette session organisée autour de deux thèmes particulièrement présents ces temps-ci.
Doxycycline post-exposure prophylaxis for STIs: Time for implementation?
La première présentation est faite par Jean-Michel MOLINA, Hôpital Saint-Louis et université de Paris Diderot-7, France, qui est un fin connaisseur de son sujet puisqu’il nous parle de prophylaxie des IST par l’usage de la doxycycline. Pour bien situer le sujet, il commence par rappeler la progression importante des IST bactériennes à l’ère des traitements et de la prophylaxie du VIH. L’OMS estime à 374 millions le nombre d’infections annuelles d’IST curables, parmi lesquelles surtout la gonorrhée, la syphilis et les infections à chlamydia. Bien que toute personne ayant des rapports sexuels peut être concerné, certains groupes sont particulièrement affectés : les jeunes de 15 à 24 ans, les hommes gays et bisexuels, les personnes enceintes et les groupes ethniques minoritaires. Que faire pour limiter les épidémies d’IST ? La première chose est la promotion encore et toujours du préservatif. La deuxième est la technique dite test and treat, dépister régulièrement et traiter immédiatement les IST chez les utilisateurs de PrEP. La troisième est la généralisation de la notification aux partenaires. LA quatrième est la vaccination des IST virales hépatites A et B, HPV, MPox. Et enfin, il existe la prophylaxie antibiotique.

Cette dernière solution n’est pas nouvelle. En 1943 le sulfathiazole était déjà expérimenté en prophylaxie des gonorrhées par des médecins militaires et en 1948 on proposait pour la même infection des pilules de pénicilline. L’agent pathogène Neisseria gonorrhoeae a une extraordinaire capacité à s’adapter à son environnement et donc à développer des mutations de résistances aux traitements qui n’ont cessé d’être changés depuis la pénicilline des années 50. D’autres antibiotiques ont été essayés en prophylaxie des IST tels que la doxycycline, l’azithromycine, et d’autres, sous différentes stratégies. La pénicilline a aussi été testée en prophylaxie de la syphilis dans les années 70. Alors pourquoi maintenant expérimenter la doxycycline en traitement post exposition ? On ne connait pas de résistance à la doxycycline de C. trachomatis et T. palladium. Elle est utilisée dans la prévention de maladie de Lyme et la leptospirose. Elle est utilisée de manière limitée en France dans le traitement d’infections bactériennes diverses et en prophylaxie de l’acné et du paludisme. En revanche, en France, N. gonorrhoeae est considéré comme résistant à la tétracycline à 65% en 2020. Trois études majeures ont démontré un bénéfice à court terme de la doxycycline en traitement de prophylaxie post-exposition (TPE doxy) dans une population HSH, incluant une forte réduction des chlamydia et syphilis avec une tolérance acceptable cependant un effet limité sur les gonorrhées. Il s’agit d’une sous-étude de l’étude IPERGAY publiée en 2018, de l’étude DOXYPEP publiée par l’équipe de Luetkemeyer en 2023, et de l’étude ANRS DOXYVAC, ces dernières présentées à la CROI 2023. Cependant à cette conférence étaient aussi présentées une étude TPE-doxy menée chez des jeunes femmes au Kenya dont les résultats sont plutôt décevants. Pour autant l’étude pharmacologique de R. Haaland et ses collègues montrait une concentration de doxycycline après une prise de 200mg largement supérieure aux concentrations requises d’inhibition de C. trachomatis, T. palladium et N. gonorrhoeae, pour peu que ce dernier soit sensible au produit, pendant au moins 72 heures.
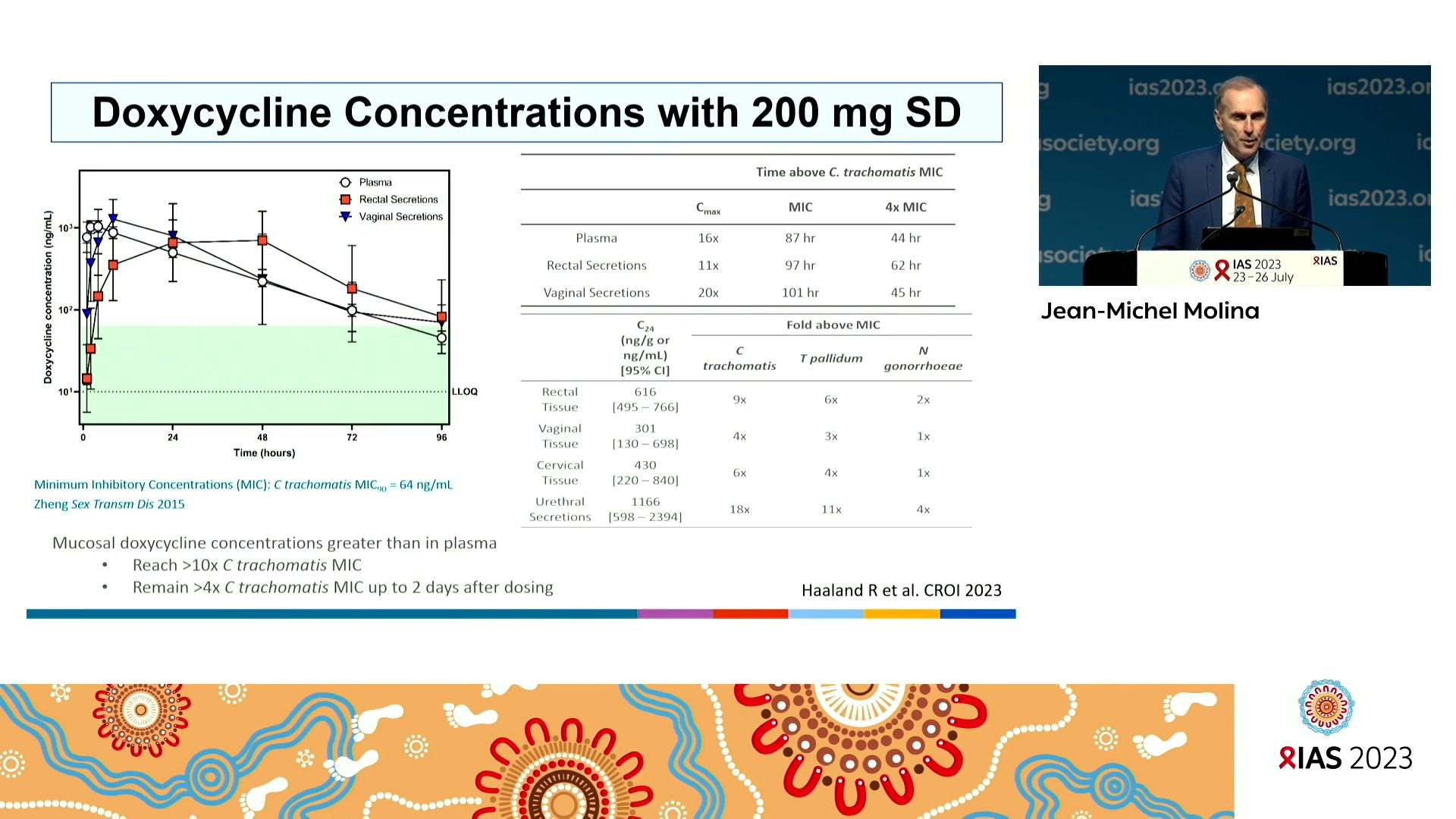
Tout ceci montre qu’il existe un certain nombre d’incertitudes à plus long terme notamment sur la sélection et la dissémination de souches plus résistantes des IST et de l’impact de cette stratégie sur le microbiome. C’est pourquoi, Jean-Michel Molina recommande la plus grande prudence pour l’implémentation de cette stratégie de prévention qui doit être réservée aux personnes les plus à risque et les plus à même d’en bénéficier et sous réserve d’une surveillance des résistances microbiennes et du microbiome. De même il est important d’impliquer les parties prenantes et les communautés concernées dans cette démarche.
mAbs for prevention
Nyaradzo Mavis MGODI, University of Zimbabwe, elle aussi nous parle de prévention, mais du VIH. Elle ouvre elle aussi son propos sur l’épidémiologie qui démontre un impérieux besoin de solutions de lutte contre cette pandémie malgré les avancées majeures en matière de traitement et de prévention. Ce qu’elle explique, c’est que dans l’attente d’un vaccin qui serait l’ultime solution à long terme, il est nécessaire de développer des stratégies de prévention à court et moyen terme. Parmi celles-ci, à côté des interventions comportementale, s’est développé la prévention biomédicale basée sur l’usage d’antirétroviraux mais aussi plus récemment d’anticorps neutralisant puissants. Nous avons besoin d’une diversité d’outils et de programmes de prévention adaptés à la diversité des besoins des gens.

L’usage des anticorps en prévention des infections virales est une histoire ancienne qui date de plus d’un siècle et a servi à combattre la rougeole, la poliomyélite, le CMV, les hépatites, la rage, la varicelle et plus récemment le SARS-CoV-2. Les vaccins les plus efficaces sont ceux capables de stimuler une production d’anticorps qui neutralisent les pathogènes. Ils sont d’ailleurs la première arme de protection de l’immunité. L’étude AMP (Antibody Mediated Prevention) qui a été proposée dans 11 pays et engagé 4925 personnes, démarrée en 2016, a consisté à leur injecter 82,5kg de l’anticorps neutralisant VRC01 en 144 474 doses. Il a montré la preuve du concept, à savoir que l’intervention à l’aide d’anticorps neutralisants est possible, qu’elle protège des souches VIH sensibles à 75% et elle a permis de disposer d’un marqueur de protection, PT80, utile pour les futurs développements, un biomarqueur de la prévention par anticorps de l’acquisition du VIH. L’anticorps utilisé dans cette recherche, VRC01, cible un seul site de neutralisation. Les études menées en ce moment qui suivent cet exemple utilisent des anticorps plus élaborés, capables de neutraliser plusieurs sites du virus, augmentant ainsi l’efficacité de la molécule mais aussi de couvrir plus facilement la diversité des virus.
L’anticorps idéal pour la PrEP est celui qui réunira les caractéristiques suivantes :

La recherche sur les anticorps en prévention du VIH progresse de manière fulgurante. Elle doit cependant s’attacher à être inclusive, respecter la diversité et l’équité, maintenir la justice et l’accès pour tous, cibler les régions où la prévalence est forte et les populations clés, être initiées avec l’objectif final en vue, l’accès, la fabrication, l’homologation et les méthodes de dispensation, s’inscrire dans le cadre d’une approche basée sur les droits humains.
Comprendre les réservoirs viraux, nouvelles technologies et populations spécifiques
Ce qui fait la persistance de l’infection à VIH même contrôlée par le traitement antirétroviral, c’est qu’il reste, dans les cellules infectées latentes, du virus intégré qui attend patiemment son heure pour s’exprimer. C’est ce qui constitue le réservoir viral. Le caractériser, le comprendre et savoir le mesurer sont des aspects essentiels qui permettent d’envisager de l’éliminer, ce qui est la clé de la guérison. Dans cette ultime plénière, il sera question de faire la synthèse des travaux de recherche qui permettent cette compréhension.
New approaches to measuring the reservoir
Pourquoi le traitement antirétroviral ne suffit pas à guérir de l’infection à VIH ? C’est par cette simple question que Ya-Chi HO, Yale University School of Medicine, United States, ouvre son propos sur la mesure du réservoir. Elle illustre son propos par une représentation très imagée de la problématique qui permet de comprendre sans plus d’explication. Nous la reproduisons ici, bien entendu.
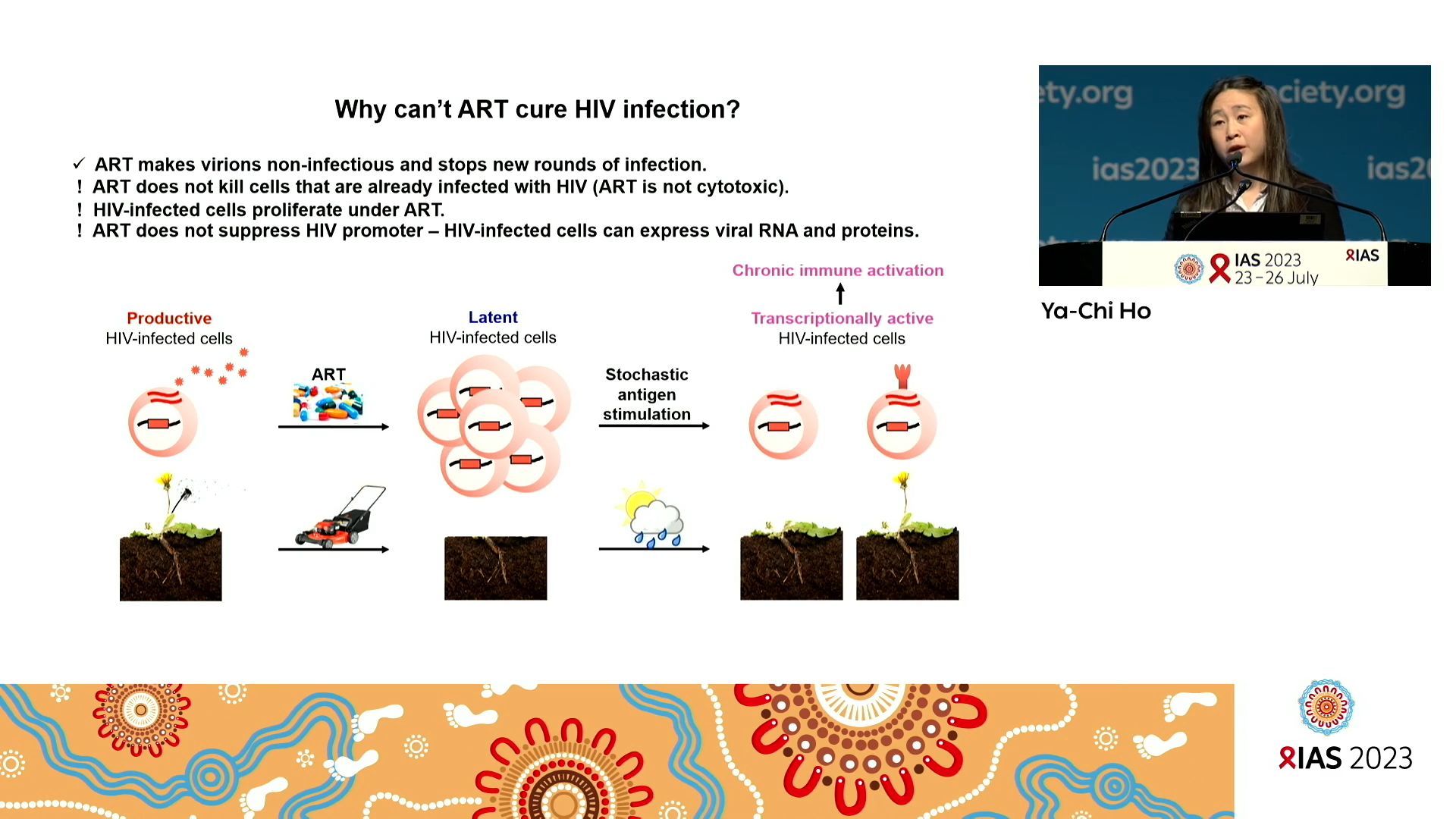
La mesure du réservoir, c’est ce qui sert de guide à la recherche de stratégies de guérison. Au cours des quarante années de l’histoire scientifique du VIH la notion et la taille du réservoir ont beaucoup évolué. Les méthodes et technologies aussi, permettant de gagner tant en précision quantitative qu’en qualité d’analyse du contenu. Ce que l’on sait aujourd’hui c’est que ce réservoir est composé de cellules infectées d’une très grande hétérogénéité. En 2002, on a découvert que les sites d’intégration de l’ADN proviral sont très variables. Si dans 90% des cas ils se situent dans des introns (des sections codantes de l’ADN), le reste n’y est pas. Puis en 2013-2014 on a découvert que l’aspect des ADN proviraux intégrés est très variable. On sait maintenant que 99% des ADN proviraux intégrés sont défectifs. Autrement dit, il n’y a que 1% des ADN proviraux intégrés qui sont transcriptionnellement actifs et donc capables de reproduire un virus. Et enfin tout récemment on a montré que l’expression de l’ARN du VIH transcrit est irrégulière. La transcription due l’ADN proviral est un peu laissée au hasard car elle ne s’inscrit pas dans le schéma si bien ordonné du fonctionnement des cellules.
L’évolution des connaissances et des technologies a changé aussi notre manière de percevoir et d’analyser le réservoir. Dans les premières décennies, on a découvert son existence et la question était de comprendre de quoi il est fait. A partir de 1997 les questions ont évolué et la préoccupation principale a consisté à le quantifier. C’est quoi la taille au juste ? Aujourd’hui, les questions de recherche se posent à l’échelle de la cellule. Il s’agit de comprendre pourquoi et comment ça marche. Les recherches de stratégies de guérison basiquement fondées sur la technique dite Shock and kill, choquer et tuer, ont beaucoup de mal à trouver leur efficacité. Les questions qu’elles ont permis de poser sont multiples : pourquoi les cellules infectées ne meurent pas, pourquoi ces cellules résistent aux mécanismes de défense immunitaire sensés les éliminer, qu’est ce qui provoque leur clonage et donc leur expansion, peut-on la contrôler, faut-il traiter l’hétérogénéité des cellules infectées avec une diversité de méthodes adaptées à chaque cas comme on s’oriente à le faire dans le traitement du cancer ? Notre approche consiste à étudier les cellules du réservoir non plus comme un ensemble mais sur la base d’une analyse cellule par cellule afin de capter l’hétérogénéité et la rareté.
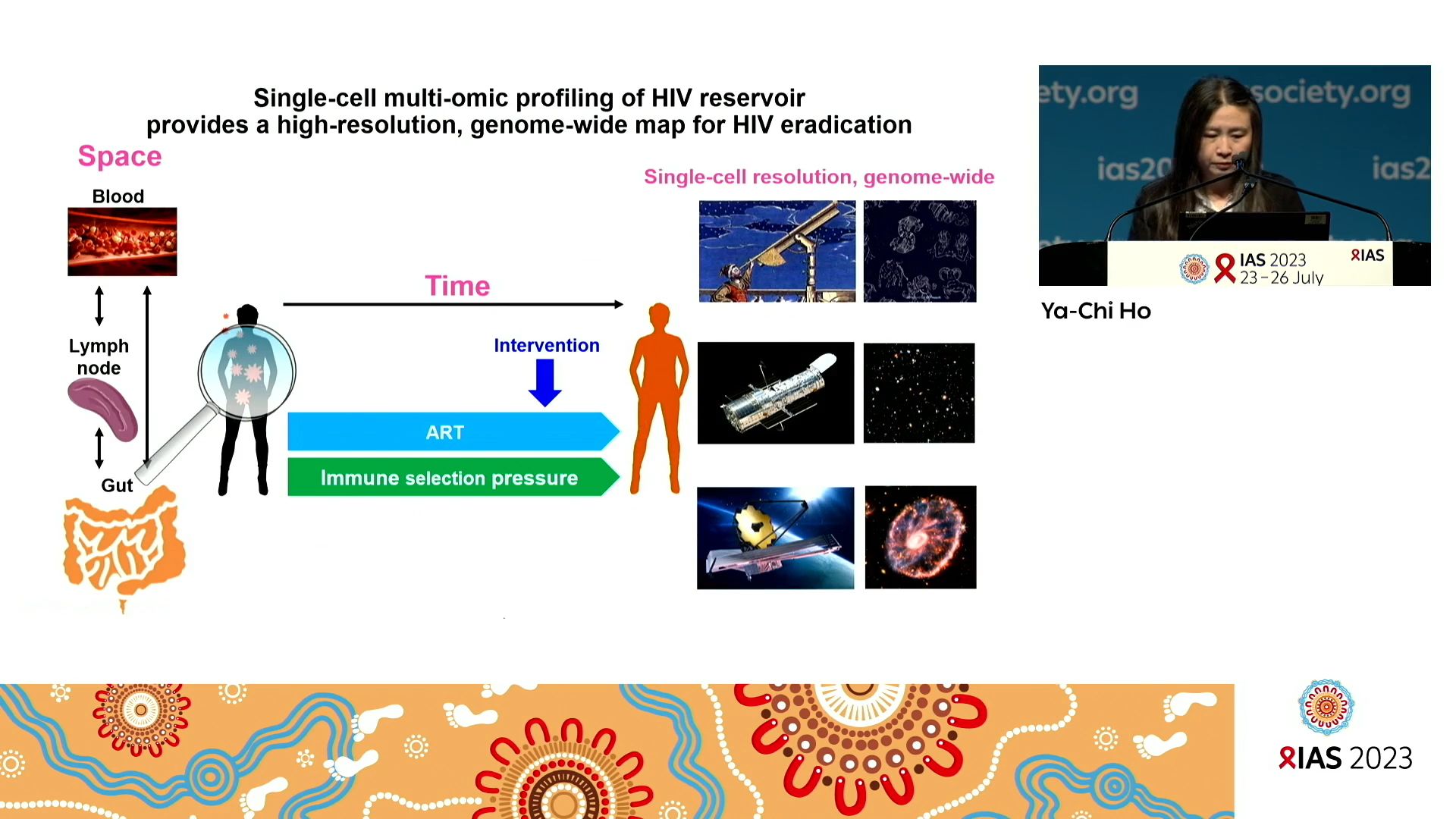
Grâce à des techniques capables de réaliser des analyses complexes sur des cellules uniques en grande série permettant d’appréhender le paysage complexe des cellules composant le réservoir, appelées ECCITEseq et DOGMAseq, la chercheuse a découvert que les cellules infectées par le VIH-1 régulaient à la hausse les gènes de réponse des lymphocytes T cytotoxiques, étaient capables de prolifération clonale, formaient des populations clonales plus importantes et plus stables et étaient principalement composées de lymphocytes T CD4+ cytotoxiques. De plus, les lymphocytes T CD4+ infectés par le VIH expriment fortement une protéine, la serpine B9, qui pourrait les protéger de la toxicité causées par les lymphocytes T CD8+ cytotoxiques. À l’aide de DOGMAseq, Ya-Chi a montré que huit gènes étaient régulés positivement dans les cellules VIH-1 latentes et transcriptionnellement actives parmi lesquels le gène IKZF3, qui a favorisé la différenciation, la survie et la prolifération des lymphocytes T CD4+ infectés. En combinant toutes ces observations, elle a mis en évidence quatre trajectoires de différenciation distinctes des lymphocytes T infectés par le VIH-1, à savoir l’activation de l’interféron, la cytotoxicité, la migration médiée par les protéines AP-1 et les phénotypes de résistance à la mort cellulaire. L’analyse multiomique unicellulaire du réservoir de VIH fournit une carte à haute résolution du réservoir de VIH latent transcriptionnellement actif. Cela améliore la compréhension des mécanismes qui permettent la persistance du réservoir du VIH, ce qui constitue un pas en avant important dans la quête de la guérison du VIH.
Understanding elite control to inform cure strategies
C’est ensuite Asier SAEZ-CIRION de l’Institut Pasteur, qui propose une analyse de ce qu’on a appris en étudiant les mécanismes virologiques et immunologiques des élite- contrôleurs du VIH et des post-traitement- contrôleurs, deux petites populations de PVVIH capables de vivre sans traitement antirétroviral grâce à une immunité capable de contrôler l’infection. Il passe en revue les différents mécanismes de contrôle naturel connus après avoir noté que la diversité génétique des VIH est aussi la cause d’une évolution de la maladie différente. Ainsi, si l’on compte moins de 0,5% de contrôleurs naturels de l’infection par le VIH-1, ils sont 15 à 30% à résister à l’infection par le VIH-2. Sur le plan génétique, des différences existent qui expliquent la réponse différenciée à la maladie. Certaines prédispositions génétiques réduisent l’expression du marqueur CCR5 utilisé par le virus comme récepteur d’entrée dans les cellules cibles. Certains marqueurs du soi, les protéines HLA, dont la diversité est grande, sont plus protectives que d’autres. Et puis les récepteurs KIR (Killer Immunoglobulin receptors) des cellules tueuses NK forment des combinaisons plus ou moins efficaces avec leur molécule HLA cible, modulant le rôle de ces cellules selon l’efficacité de cette liaison. Mais ces facteurs génétiques ne sont ni nécessaires, ni suffisants pour permettre le contrôle du VIH. L’étude des contrôleurs post-traitements, des personnes qui, après une interruption de traitement s’avèrent capables de contrôler naturellement l’infection, reste encore une énigme à résoudre. Certains facteurs génétiques peuvent être mis en cause mais cela reste paradoxal.
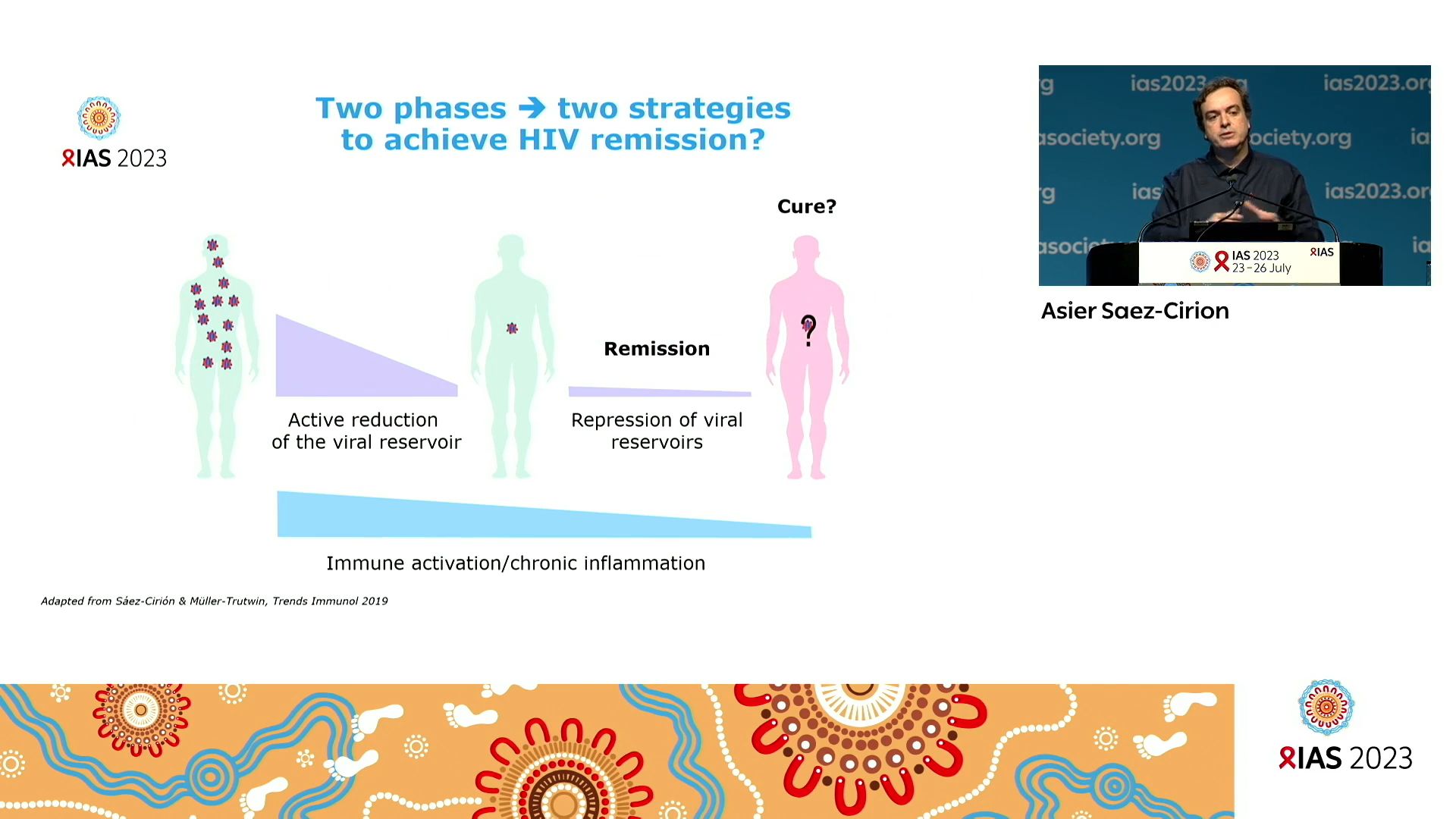
Ce que l’on a appris en étudiant l’immunité de toutes ces personnes c’est l’importance 1) de leur réponse immunitaire innée qui se manifeste selon différents mécanismes ; 2) de leur réponse coordonnée des anticorps neutralisants ; 3) de leur capacité à développer des lymphocytes T CD8+ de meilleure qualité, capables de contrôler l’infection par le VIH.
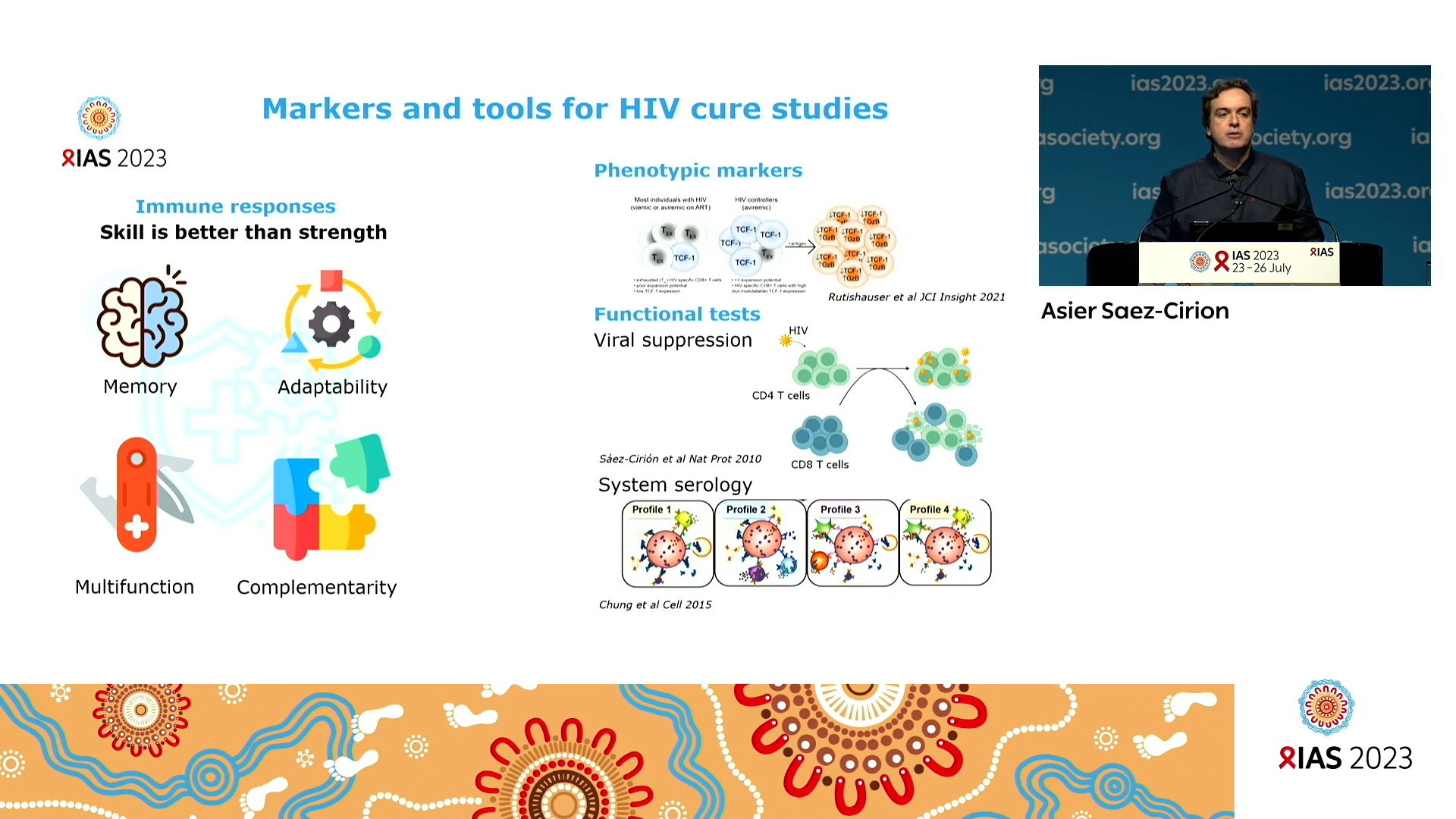
Pour autant, la qualité de vie des personnes qui contrôlent le VIH est elle meilleure que les autres PVVIH ? Les études socio comportementales menées chez ces personnes montrent que s’ils présentent un avantage quant à leur santé physique et leurs symptômes ainsi que dans leur vie sociale et relationnelle, ils sont plus fragiles en termes de questions de santé et de détresse mentale. Ces enquêtes identifient cela comme dus à une incertitude de l’avenir et de leur statut, l’absence d’identification à un groupe social défini malgré le ressenti de la stigmatisation similaire aux personnes vivant avec le VIH.
L’étude des élite- contrôleurs du VIH et des post-traitement- contrôleurs nous procure des ressources précieuses dans la vie réelle pour nous aider à comprendre les mécanismes immunologiques et virologiques qui sous-tendent leur contrôle du VIH. Cette idée est essentielle pour le développement de futures stratégies thérapeutiques et de guérison du VIH.
Tous les articles IAS 2023 à retrouver ici :
- IAS 2023, tous les sujets en plénière -1-
- IAS 2023, tous les sujets en plénière -2-
- IAS 2023 : d’autres sessions, morceaux choisis
L’article introductif :
