Comment évolue l’immunité une fois qu’on est infecté par le VIH ? C’est une question cruciale pour les épidémiologistes mais aussi pour prendre en main sa santé et faire les meilleurs choix en fonction de sa propre vie.
Cette étude basée sur un recueil de données très documenté de personnes séropositives non seulement répond à la question posée par les chercheurs mais démontre s’il le fallait encore la nécessité du dépistage et l’intérêt d’un suivi médical après un résultat de dépistage positif.
Il y a actuellement environ 5 millions de personnes dans le monde qui prennent un traitement antirétroviral. La révision des recommandations internationales passant le seuil du taux de lymphocytes CD4/mm3, seuil à partir duquel on considère comme bénéfique l’initiation d’un traitement, de 350 à 500 dans certains pays occidentaux et de 200 à 350 dans les pays du sud devrait conduire à l’augmentation du nombre de personnes sous traitement.
Ces changements sont essentiellement dus à l’observation d’un bénéfice à l’initiation précoce du traitement ainsi qu’à la réduction de mortalité et de morbidité lorsque le traitement est initié au dessus de 500 CD4.
Dans le contexte de crise financière mondialisée, il devient d’autant plus important de planifier les dépenses de santé et de rendre accessible les traitements anti-VIH à toutes les personnes qui le nécessitent. La durée entre la contamination et la baisse du taux de lymphocytes CD4 jusqu’à 500, 350 et 200 est mal connue mais nécessaire pour permettre la planification des besoins à venir et des coûts.
D’où l’intérêt d’une étude de ce type produisant un résultat statistique le plus précis possible sur l’évolution dans le temps de l’immunité d’un séropositif après la contamination utilisant un marqueur de l’immunité très standardisé, le compte de lymphocytes T CD4/mm3.
Méthode
La base de données étudiée est celle de CASCADE (Concerted Action on Seroconvertion to AIDS and death in Europe). Elle est constituée des données de 25 cohortes de personnes dont on connaît bien la date de séroconversion, issues d’Europe, d’Australie, du Canada et d’Afrique sub-saharienne. Les données extraites de la base concernent 21240 personnes séropositives au VIH. Dans le but de pouvoir estimer les dates de contamination, les investigateurs ont recherché les dates de séroconversion à l’aide de différentes méthodes selon les données connues (mi-parcours entre le dernier test négatif et le test positif, données de laboratoire prouvant a séroconversion, évolution des anticorps, PCR positive en l’absence d’anticorps et Western blot incomplet, date connue de signes cliniques de séroconversion…). Un certain nombre de cas insuffisamment documentés ont été écartés de même que les données de compte de lymphocytes CD4 au-delà de 10 ans ou trop proches de la séroconversion. Enfin, les données retenues ne concernent que les personnes au dessus de 16 ans étant donné la disparité de la décroissance des CD4 des enfants par rapport aux adultes.
Le temps zéro a été fixé à la séroconversion. Le modèle statistique a été construit à la fois à partir de la proportion de personnes aux différents seuils considérés à 1, 2 et 5 ans ainsi qu’aux temps connus pour atteindre les seuils de 500, 350 et 200 lymphocytes CD4. L’analyse a ensuite été stratifiée en fonction de l’âge (mois de 25, 25 – 29, 30 – 34 et plus de 35), du sexe, des groupes de transmission (HSH, HSF et FSH) et du fait que la séroconversion a eu lieu avant ou après 1996, date de la mise à disposition des trithérapies.
Résultats
Finalement l’analyse a inclus les résultats de 18495 personnes dont 78% d’hommes en général et 55% de HSH. L’âge médian de séroconversion est de 30 ans (IQR 25-37). La moitié environ a été contaminée avant l’arrivée des trithérapies (1996). Le suivi moyen entre la séroconversion et le traitement a été de 3,74 ans (IQR 1.48-7,00). Mais 2% des personnes sont décédées avant d’avoir eu un traitement, presque toutes ces personnes ayant eu leur séroconversion avant 1996.
À 1, 2 et 5 ans, les comptes médian de CD4/mm3 étaient respectivement de 510 (IQR 341-721), 460 (IQR 294-656), et 315 (IQR 156-528). La figure 1 qui représente l’évolution des proportions de personnes sous les différents seuils considérés de 500, 350 et 200 lymphocytes CD4/mm3 montre que 48% des séropositifs seraient éligible à un traitement à un an de la séroconversion en considérant le seuil de recommandation du traitement à 500 CD4/mm3 contre 26% à 350 et 9% à 200. Au bout de 5 ans 56% sont en dessous du seuil de 350 CD4/mm3 et 33% sous les 200.
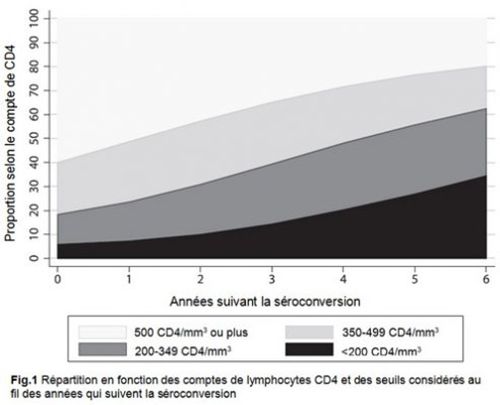
Les temps estimés d’évolution jusqu’aux seuils considérés dans l’étude sont de 1,19 ans (Intervalle de Confiance à 95% : 1,12-1.26) pour atteindre 500 CD4/mm3, 4,19 ans (IC95 4,09-4,28) pour atteindre 350 CD4/mm3 et 7,93 ans (IC95 7,76-8,09) pour arriver à 200 CD4/mm3.
Effet des caractéristiques individuelles
Parmi les caractéristiques individuelles susceptibles de moduler les résultats, les chercheurs ont noté que plus on est âgé lors de sa séroconversion, plus la décroissance des lymphocytes CD4 est importante ; les femmes ont globalement un compte de CD4 à la séroconversion plus élevé que les hommes mais le sexe n’influence pas la décroissance des CD4 ; les personnes dont la séroconversion date d’avant les trithérapies (1996) ont en général un compte de CD4 à la séroconversion plus bas que ceux qui ont été contaminés plus récemment et certains éléments montrent que chez ces derniers, la décroissance des CD4 est plus lente. Enfin, les personnes contaminées par relations hétérosexuelles ont eu une décroissance sensiblement moins prononcée que les HSH ou les usagers de drogues intraveineuses.
Tous ces facteurs influencent le temps nécessaire depuis la séroconversion jusqu’au seuil de 200, 350 ou 500 lymphocytes CD4/mm3. Les durées moyennes estimées varient entre 8 à 10 ans pour atteindre 200 CD4, 4 à 5 ans pour atteindre 350 CD4 et moins de 2 ans pour arriver à 500 CD4. Les caractéristiques individuelles modulant ces résultats, les temps pour atteindre respectivement 200, 350 et 500 CD4/mm3 sont de 10,71 ans, 5,66 ans et 1,63 ans pour des femmes hétérosexuelles âgées de 25 à 30 ans, ils sont de 7,67 ans, 3,94 ans et 0,95 ans pour des hommes homosexuels âgés de 30 à 35 ans et de 9,15 ans, 4,08 ans et 0,04 ans pour des hommes hétérosexuels de 30 à 35 ans.
Discussion
Les résultats de l’étude montrent qu’un séropositif atteindra le seuil de 500 lymphocytes CD4/mm3 environ 1 an après la séroconversion, 350 CD4 après 4 ans et 200 CD4 après 8 ans. Les estimations produites montrent également que sur 100 personnes nouvellement contaminées, après un an, 48 personnes devront prendre un traitement antirétroviral si le seuil de recommandation est de 500 CD4/mm3. Après 5 ans, 55 personnes seront en dessous de 350 CD4/mm3. Ces données sont essentielles pour planifier le besoin d’accès au traitement des séropositifs au VIH dans les années à venir. Mais elles montrent aussi que pour prévenir un accès tardif au traitement, il est nécessaire d’encourager le dépistage.
Cette étude est la plus importante qui ait été conduite pour évaluer le temps entre la séroconversion et les seuils de lymphocytes CD4 critiques pour l’utilisation des traitements antirétroviraux.
Les résultats tendent à démontrer que plus l’âge à la séroconversion est avancé, plus le compte de lymphocytes CD4 à la séroconversion est bas et plus la décroissance des CD4 sera rapide.
Les chercheurs ont aussi confirmé que le compte de CD4 à la séroconversion des femmes était plus élevé que celui des hommes mais que la différence des sexes n’affectait pas la décroissance des CD4. Ainsi, les femmes atteignent les seuils visés plus longtemps, de 2 à 11 mois plus tard, que les hommes, tous autres paramètres égaux par ailleurs, mais il n’existe pas de données à long terme permettant d’envisager une mise sous traitement différente selon les sexes.
Enfin, certaines limitations dans cette étude, notamment le fait que la très large majorité des données utilisés proviennent de personnes infectées par un sous-type viral B, font que les résultats ne sont pas nécessairement généralisables comme tels aux pays du sud où le sous-type B n’est pas majoritaire et où la diversité génétique des virus est élevée. Les observations sur les personnes porteuses de sous-types D montrent le plus souvent des résultats plus défavorables.
L’ensemble des résultats, très utile en matière de décisions de santé publique, montre tout l’intérêt d’encourager un dépistage précoce, particulièrement auprès des populations les plus exposées, afin de promouvoir un accès au traitement au meilleur moment.
de l’épidémie cachée dont le calcul s’appuie sur les données présentées ici.
Enfin, ces résultats montrent aussi l’intérêt de ne pas en rester à un résultat positif suite à un dépistage mais d’intégrer le processus de suivi médical qui permet de vivre sa séropositivité dans les meilleures conditions.
Source :
Lodi S, Phillips A, Touloumi G, Geskus R, Meyer L, Thiébaut R, Pantazis N, Amo JD, Johnson AM, Babiker A, Porter K ; CASCADE Collaboration in EuroCoord.
Time from human immunodeficiency virus seroconversion to reaching CD4+ cell count thresholds <200, <350, and <500 Cells/mm³ : assessment of need following changes in treatment guidelines.
Clin Infect Dis. 2011 Oct ;53(8):817-25. doi : 10.1093/cid/cir494.
C’est très technique, vu comme ça. Mais n’est-il pas utile de comprendre de quoi sont faites les données scientifiques sur lesquels nous basons nos jugements personnels ? Dans un prochain article d’épidémiologie à paraître, nous aborderons la question de l’épidémie cachée dont le calcul s’appuie sur les données présentées ici.
Enfin, ces résultats montrent aussi l’intérêt de ne pas en rester à un résultat positif suite à un dépistage mais d’intégrer le processus de suivi médical qui permet de vivre sa séropositivité dans les meilleures conditions.
