Voici les résultats de l’essai de PrEP de l’ANRS, IPERGAY, tels qu’ils ont été présentés à la CROI, la conférence sur les rétrovirus américaine, en février dernier. L’essai IPERGAY est un essai de prévention biomédicale de Prophylaxie pré-Exposition (PrEP) (voir aussi notre dossier complet sur la PrEP). La rédaction vous propose une traduction complète de cette présentation afin de la rendre accessible à tous.
Les résultats de l’essai ANRS IPERGAY ont été reconnus comme une avancée majeure de la recherche en matière de prévention biomédicale de la transmission du VIH. Pour bien comprendre le sens de ce que ces résultats nous apportent, il convient de ne pas se limiter à une seule valeur d’efficacité mais de revoir l’ensemble des résultats. C’est ce que nous avons voulu proposer dans nos colonnes en proposant la version française de la présentation de l’investigateur principal de l’essai, le professeur Jean-Michel Molina à la prestigieuse conférence américaine, la CROI en 2015.
Si les images que nous reproduisons sont les originales, donc en anglais, les explications du texte permettent aisément de les comprendre. Pour faciliter encore la compréhension nous avons ajouté quelques notes explicatives aux endroits importants. En effet, le langage des conférences scientifiques est un langage de spécialistes et de conventions, parfois difficile à interpréter.
L’autre résultat important d’essai PrEP présenté à la CROI 2015 est celui de l’essai britanique PROUD.
Pour mieux comprendre la PrEP vous pouvez aussi consulter notre dossier : Comprendre la prophylaxie pré-exposition ou PrEP
Présentation de Jean-Michel Molina « On Demand PrEP With Oral TDF-FTC in MSM : Results of the ANRS Ipergay Trial » à la session du 24 février 2015 « Oral Abstract : Preventing HIV and HSV-2 : What Will It Take ? » de la conférence sur les rétrovirus et les maladies opportunistes (CROI) 2015 à Seattle (WA), USA.

Jean-Michel Molina : « Au nom du groupe ANRS IPERGAY, je remercie les organisateurs de nous avoir invités à présenter les résultats de notre essai. »
Le nombre de nouvelles infections par le VIH en France ainsi qu’au Canada chez les hommes ayant des relations sexuelles avec d’autres hommes (HSH) est très élevé.

Les résultats des précédents essais de PrEP orale quotidienne ont donné lieu à des résultats controversés principalement dus au talon d’Achille de cette stratégie, l’observance à un traitement continu. Il nous faut donc inventer des procédés plus appropriés d’utilisation de cette stratégie et la PrEP à la demande en est un.
La PrEP à la demande est un moyen de rendre ce mode de prévention plus adéquat, plus intéressant du point de vue coût/efficacité et plus attrayant.
L’intérêt de la PrEP à la demande est confirmé par les données des modèles animaux.
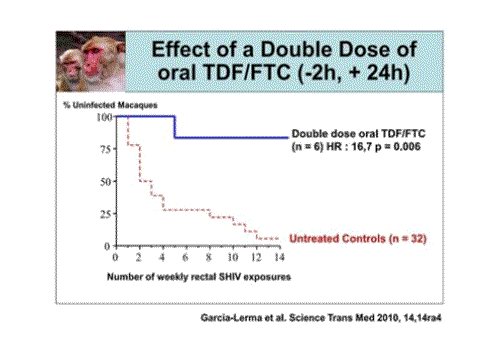
Ces données présentées par le groupe de Garcia-Lerma et ses collègues du CDC en 2010 montre qu’en donnant une double dose de TDF/FTC [appellation standardisée pour la combinaison de deux molécules, tenofovir et emptricitabine en un comprimé commercialisé par le laboratoire Gilead sous le nom de Truvada® Cette appellation sera utilisée dans toute la présentaion qui suit] deux heures avant une exposition au virus SHIV et une dose 24 heures après à des macaques soumis à ce régime chaque semaine, ils sont totalement protégés comparés à des animaux non traités.
C’est sur ce modèle que nous avons conçu l’étude dénommée IPERGAY qui signifie « intervention préventive de l’exposition aux risques avec et pour les gays ». Cette étude qui a été construite en liaison avec la communauté gay, a bénéficié d’un puissant soutien de cette communauté en France et au Canada.

Cette image montre le schéma de l’étude. Il s’agit d’un essai randomisé contre placebo, en double aveugle [ni les participants, ni l’équipe de l’essai ne sait ce que chaque participant prend, médicament actif ou placebo] d’une PrEP à la demande recrutant des HSH à haut risque, défini par le fait d’avoir eu des rapports non protégés avec au moins deux partenaires dans les six derniers mois, et dont le débit de filtration glomérulaire est normal [indicateur d’un fonctionnement normal des reins qui sont la voie d’élimination des médicaments utilisés dans l’essai].
Les participants ont été répartis équitablement en deux groupes recevant en plus de services de prévention, un placebo ou le TDF/FTC à prendre avant et après les rapports sexuels.
Le critère principal de jugement de l’essai déterminant le point d’arrêt de l’étude randomisée était défini avec une puissance statistique de 80% comme une réduction minimale de 50% de l’incidence de la transmission du VIH avec l’utilisation de TDF/FTC à la demande, l’incidence attendue dans le groupe placebo étant de 3/100 personnes-années.
Le suivi des participants était prévu au premier et au deuxième mois et ensuite tous les deux mois.
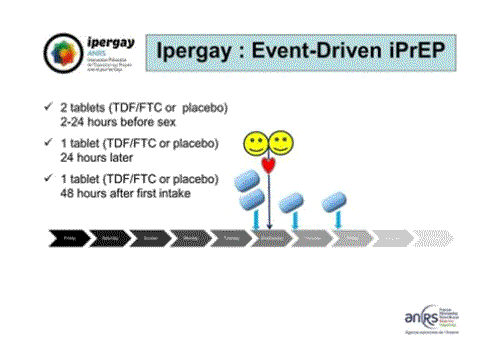
Cette image montre le schéma type de prise dans IPERGAY. Les instructions données aux participants étaient de prendre 2 comprimés vingt-quatre heures avant un rapport sexuel, un troisième comprimé 24 heures après la prise précédente et après le rapport et un quatrième comprimé 48 heures après la première prise. Au total, quatre comprimés pour un rapport sexuel.

Le critère principal de jugement était mesuré en utilisant un test diagnostic de l’infection à VIH de 4e génération ainsi qu’un test de recherche de l’ARN viral destiné à mesurer l’ancienneté de la contamination.
Le critère secondaire de jugement comprenait l’étude de la sécurité et la tolérance, l’observance de la stratégie en utilisant le comptage des comprimés, des dosages de médicament dans le sang et des auto-questionnaires sur ordinateur, une étude comportementale sur l’usage des préservatifs, la fréquence des rapports sexuels et le nombre de partenaires, les infections sexuellement transmissibles.
Le 24 octobre 2014, le comité indépendant de l’essai a recommandé l’arrêt du groupe placebo en raison d’une accumulation de résultats suffisants pour prouver la forte efficacité de la technique étudiée et la mise à disposition de la PrEP à la demande pour tous les participants. [Le comité indépendant, en anglais : Data Safety Monitoring Board ou Comité d’observation des données de sécurité, est composé de spécialistes indépendants de l’essai qui assurent la sécurité des personnes participant à la recherche en examinant à intervalle régulier les données des participants. Dans un essai en double aveugle, comme ici, ils sont les seuls à savoir ce que prennent les personnes]
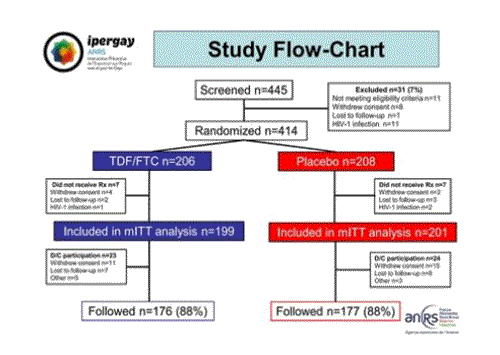
Cette image montre le diagramme de l’étude :
- 445 personnes ont été pré-incluses,
- 414 personnes ont été randomisées, 206 dans le groupe TDF/FTC et 208 dans le groupe placebo,
- Les données de 400 personnes ont été validées (199 dans le groupe TDF/FTC et 201 dans le groupe placebo) pour produire l’analyse du résultat en intention de traiter,
- 88% des participants ont été jusqu’au bout de leur suivi dans l’étude, ce qui représente un résultat de rétention dans l’essai tout à fait satisfaisant.
Les caractéristiques des participants à l’inclusion dans l’essai sont très comparables entre les deux groupes :
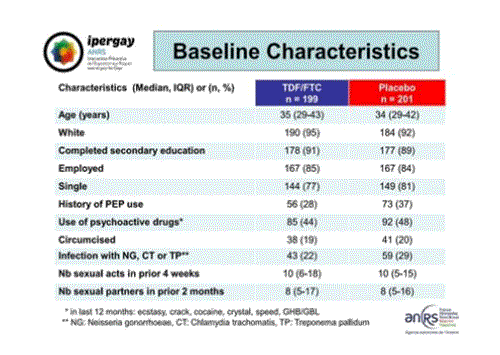
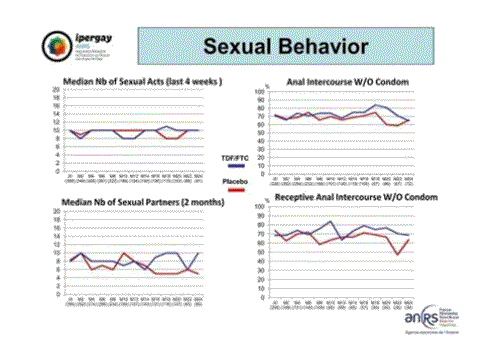
Tout au long de l’étude on a observé une forte stabilité des comportements. Les valeurs médianes indiquent une dizaine d’actes sexuels au cours des 4 semaines précédentes, de 6 à 10 partenaires dans les deux mois précédents, environ 70% de rapports anaux sans préservatifs.
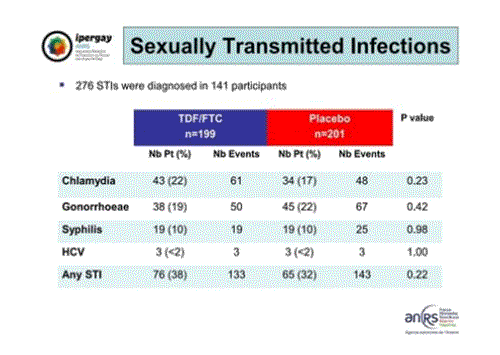
Cela explique au moins en partie que l’on ait observé autant d’infections sexuellement transmissibles. En effet un tiers des participants ont eu au minimum une infection sexuellement transmissible sans différence du groupe dans lequel ils étaient inclus. Au total 276 IST (Chlamydia, Gonorrhées, Syphilis et hépatites C) ont été diagnostiquées chez 141 participants.
Pour ce qui est de l’efficacité, le critère principal de jugement de l’essai, cette image présente le diagramme de Kaplan-Meyer qui exprime la progression dans le temps des contaminations par le VIH dans les deux groupes de l’essai des participants retenus dans l’analyse en intention de traiter [l’analyse « en intention de traiter » signifie que l’on considère le succès ou l’échec de chaque personne selon le groupe dans lequel il a été mis au départ et non pas selon qu’elle a suivi ou non le protocole de traitement prévu dans son groupe. Cela s’oppose à une analyse « selon traitement » qui tient compte de ce qui a été effectivement réalisé chez chaque personne mais donne une preuve statistique plus faible].
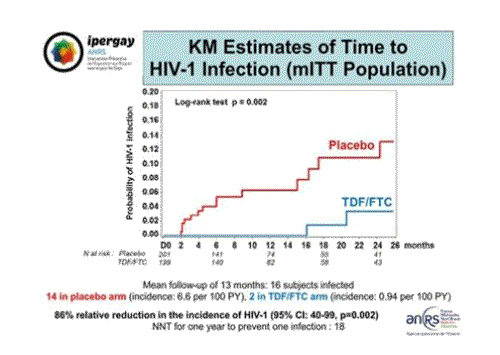
On observe une différence très significative entre la progression dans le groupe TDF/FTC (en bleu) et le groupe placebo (en rouge). Avec une durée moyenne de participation de chaque personne dans l’étude de 13 mois, 16 personnes étaient contaminées, 14 dans le groupe placebo (incidence de 6,6 pour 100 personnes-années) et 2 dans le groupe TDF/FTC (incidence de 0,94 pour cent personnes années). Les deux personnes infectées dans le groupe TDF/FTC l’ont été après 16 mois de participation à l’essai. Les analyses ont révélé qu’ils avaient abandonné l’usage du produit, ce qu’ont confirmé les dosages sanguins qui ne montrent aucune trace de médicament au moment de l’infection et même à la visite précédente.
Ces données démontrent donc une réduction relative de 86% de l’incidence de l’infection par le VIH par l’usage d’une PrEP de TDF/FTC à la demande comparée à un placebo avec un intervalle de confiance à 95% de 40 à 99. [l’intervalle de confiance indique dans quelle mesure le résultat obtenu est reproductible. Ces données-ci disent qu’en répétant l’expérience dans les mêmes conditions, l’efficacité obtenue dans 95% des cas sera comprise entre 40 et 99].
Cela signifie que le nombre de personnes qu’il faut traiter pour éviter une infection en un an est de 18.
Qu’en est-il de l’observance ?
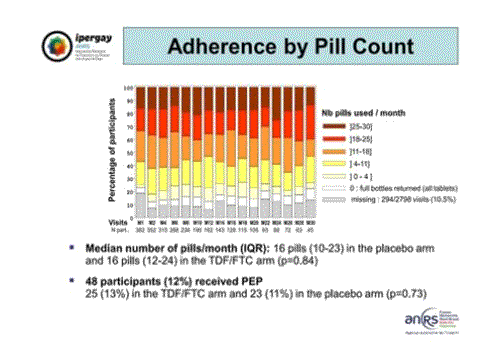
L’observance a été mesurée en premier par le comptage de pilules dans l’essai et cette image montre le compte de pilules relevé pour chaque participant à chaque visite en cumulant les deux groupes. Le nombre de pilules moyen par mois par personne était de 16, et égal dans les deux groupes au lieu de 30 s’ils avaient été en traitement continu, soit environ 4 pilules par semaine.
Par ailleurs, 48 participants ont eu recours à un traitement post-exposition (TPE) durant l’essai, 25 dans le groupe TDF/FTC et 23 dans le groupe placebo.
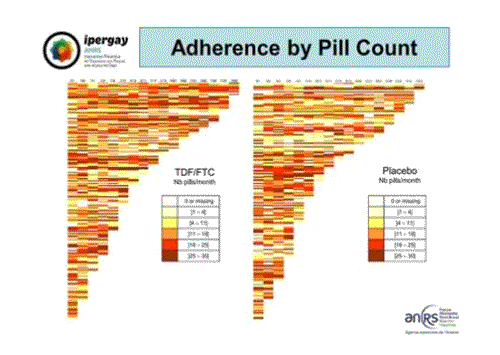
Une autre façon de représenter l’utilisation de la PrEP par les participants de l’essai est cette représentation du comptage des pilules dans lequel chaque ligne figure l’usage par tranche de 2 mois de chaque participant, à gauche dans le groupe TDF/FTC et à droite dans le groupe placebo. Cela montre une très forte hétérogénéité dans un groupe comme dans l’autre, ce qui montre clairement l’appropriation par les participants de l’utilisation à la demande.

Un autre moyen de mesurer l’observance est d’analyser les questionnaires comportementaux concernant le dernier acte sexuel. Ils nous renseignent sur 1212 actes de 319 participants. Ils montrent que 28% des participants n’ont pas utilisé de PrEP lors de leur dernier rapport sexuel et que les participants sélectionnent le type de partenaire ou de rapport pour lequel ils utilisent la PrEP.
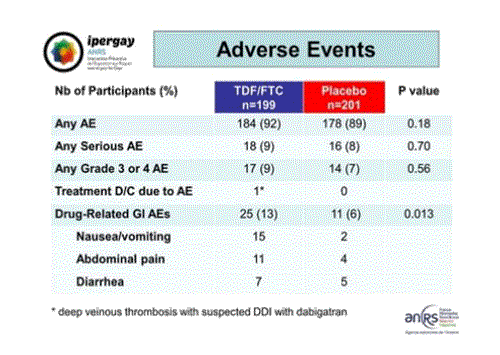
En termes d’effets indésirables, cette image montre qu’il n’y a pas de différence entre les deux groupe en général, que ce soit en nombre ou en sévérité. Un seul participant du groupe TDF/FTC a arrêté l’usage de la PrEP pour cause d’effet indésirable. Il est très probable que le problème soit dû à une interaction médicamenteuse avec un traitement anticoagulant pris par cette personne. Il n’y a que pour les troubles gastro-intestinaux qu’on observe une différence significative entre les deux groupes, qu’il s’agisse de nausées, de vomissements ou de diarrhées.
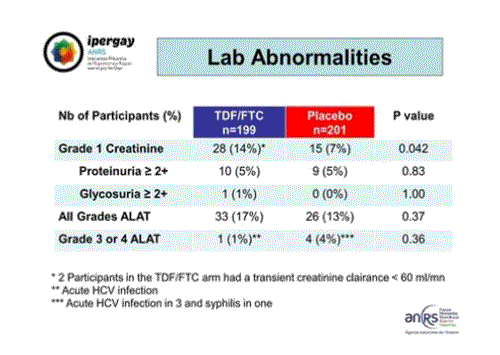
Pour ce qui est des anomalies relevées dans les analyses biologiques, là encore, on n’observe aucune différence significative entre les deux groupes si ce n’est une élévation légèrement supérieure de la créatinine dans le groupe TDF/FTC. Par ailleurs, les modifications de grade 3 des enzymes du foie (ALAT) ont été observées chez des personnes présentant une hépatite C ou une syphilis.

En conclusion, dans cette population de HSH à haut risque, l’incidence de l’infection par le VIH a été supérieure à ce qui était attendu.
La PrEP à la demande s’est révélée très efficace avec une réduction relative de 86% de l’incidence de l’infection par le VIH.
L’observance de la stratégie a été bonne, ce qui montre l’acceptabilité d’une PrEP à la demande.
La sécurité d’utilisation du TDF/FTC à la demande a été similaire à celle observée dans le groupe placebo exception faite de plus d’événements indésirables gastro-intestinaux dans le groupe TDF/FTC.
Il n’a été observé aucun effet de compensation du risque dans les conditions de cette étude.
Ainsi l’on peut affirmer que la PrEP à la demande est une alternative intéressante à la PrEP en continu pour des HSH à haut risque qui n’utilisent pas systématiquement le préservatif.

Remerciements aux participants de l’essai, à l’équipe de l’étude et aux accompagnateurs, au comité scientifique de l’essai, au comité indépendant, au comité associatif, à l’équipe de l’ANRS, au SC10 (méthodologie et gestion) ainsi qu’au promoteur de l’essai, l’ANRS et aux soutiens financiers de l’étude, le Canadian HIV Trial Network, la fondation Bill and Melinda Gates, la fondation Pierre Bergé, Sidaction et le laboratoire Gilead.
