La 10e conférence de l’IAS sur la recherche VIH s’est tenue à Mexico du 21 au 24 juillet 2019. Ce tour d’horizon des huit présentations scientifiques des sessions plénières donne une vision de ce que la conférence a voulu mettre en avant parmi toutes les thématiques présentées lors de cette rencontre.
La Dixième conférence internationale de l’IAS a été extrêmement riche de contenu et de rencontres. Il a été impossible pour une seule personne de tout suivre et de tout voir tant la densité des sessions était grande et pour autant toutes attractives. Même à deux nous avons dû faire des choix. C’est donc avec enthousiasme et satisfaction que nous sommes revenus de Mexico. Pour tenter de partager le mieux possible les contenus qui nous ont intéressés le plus pour alimenter la connaissance du site reactup, voici en premier lieu une synthèse des sessions plénières. D’autres articles plus spécifiques suivront.

Nous vous proposons ici un résumé des différentes communications faites en session plénière de la conférence internationale de l’IAS qui s’est tenue cet été 2019 à Mexico. Chacune de ces plénières est un petit résumé d’un sujet de session plus étendu dans la conférence. Il représente donc un éventail des sujets les plus marquants de cette dixième conférence scientifique de l’IAS.
Certains sujets seront repris et approfondis dans quelques articles suivants.
Lundi, session MOPL01
« Mettre à niveau les traitements dans les pays à ressources limitées, que va nous coûter le troisième 90 » par Gloria Malmela, Afrique du Sud
C’est par des histoires de vies individuelles que Gloria commence son propos afin de nous faire comprendre que le passage à l’échelle souhaité par l’ONUSIDA se heurte à des aspects très simples de difficultés des individus sur le terrain. La cascade de prise en charge au niveau mondial est en 2018 à 75%,79%,81% encore loin de l’objectif des 90% de personnes vivant avec le VIH diagnostiquées, dont 90% sont sous traitement, dont 90% ont atteint le seuil de charge virale indétectable telle que visé par l’ONUSIDA pour 2020.
L’insuffisance des systèmes de santé en Afrique fait que les personnes sont souvent trop éloignées des structures de dispensation de soins pour assurer un suivi régulier. L’avenir pour atteindre le troisième « 90 » c’est de développer les approches basées sur la personne, les organisations communautaires et de favoriser les innovations qui répondent aux besoins exprimés par les personnes. Mais il s’agit aussi de conduire des analyses de type cascade de prise en charge à un niveau de détail qui permette de comprendre les manques sur le terrain surtout là où les besoins sont mal couverts. Il s’agit aussi de diversifier les solutions en s’adaptant au terrain, le concept de la taille unique pour tous doit être oublié. Enfin il s’agit de savoir combiner toutes les ressources aux différents niveaux et d’assurer la compréhension et la communication entre les acteurs. Il faut savoir diversifier les approches et combiner les solutions plutôt que d’attendre une multiplication des moyens si l’on veut arriver à augmenter l’accès aux antirétroviraux et réduire l’incidence du VIH.
« Manipulations des cellules souches et du génome pour guérir le VIH » par Paula Cannon, USA-Californie
Non seulement le VIH échappe au système immunitaire mais le fait qu’il intègre son génome dans celui des cellules qu’il infecte rend les solutions de guérison peu probables et difficiles à envisager. Que peuvent les solutions de thérapie géniques ? Protéger les cellules cibles, améliorer la réponse immunitaire, éliminer le réservoir des cellules latentes. Les outils dont nous disposons actuellement, CRISPR-CAS9 et les nucléases à doigt de zinc, permettent une intervention sur le génome extrêmement précise.
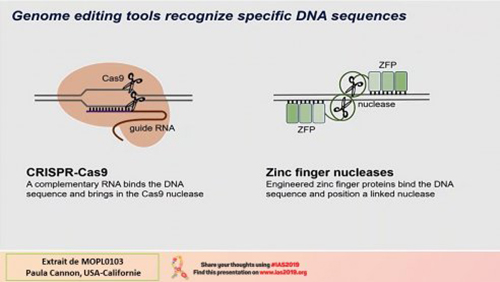
De plus, il est possible de tirer parti des dispositifs cellulaires de réparation de l’ADN pour améliorer encore ces interventions, que ce soit en éteignant l’expression de gènes pour en obtenir une résistance au VIH, en interrompant un matériel génétique proviral intégré ou bien à l’aide de modèles de reconstruction, en introduisant des gènes anti-VIH. La manipulation ciblée des cellules souches hématopoïétiques, cellules à l’origine de tous les composants et cellules du sang, permet d’obtenir des lignées modifiées nouvelles dans tout l’organisme. Il sera question ici de deux exemples de ce qu’il est possible de faire. La première cible est le gène du récepteur CCR5 qui sert de co-récepteur pour l’entrée du VIH dans les cellules qu’il infecte. Les rares personnes possédant un gène déficient CCR5 ?32 sont résistantes naturellement au VIH. Par ailleurs, la greffe de cellules souches d’un donneur possédant cette mutation à un séropositif a permis la guérison d’au moins une personne, Timothy Braun, encore appelé « le patient de Berlin ». Rappelons au passage que cette greffe a été utilisée pour soigner une leucémie dont il souffrait en plus de l’infection par le VIH. Ces exemples suggèrent que le gène CCR5 est une cible intéressante pour la thérapie génique. Plusieurs équipes dans le monde tentent actuellement des expérimentations dans ce sens dont une équipe parisienne. La cible CCR5 est-elle pour autant le meilleur choix ? Une étude sur la longévité des personnes montre que les individus CCR5 ?32 auraient une espérance de vie très légèrement diminuée. Cela nous montre que lorsqu’on utilise une solution de thérapie génique pour le bénéfice immédiat d’une personne, il faut aussi se poser la question du risque à long terme. L’autre exemple de thérapie génique est celui utilisant la technique d’un modèle de reconstruction. Dans cette recherche, la suppression du gène CCR5 a été suivie d’une tentative d’implémenter un gène permettant de coder un anticorps neutralisant anti-VIH. D’autres tentatives sont à l’étude, notamment celle d’implémenter le gène d’un agent inhibiteur d’entrée du VIH. Enfin, la manipulation génique pourrait aussi s’intéresser au génome intégré du VIH en ciblant les cellules latentes qui constituent le réservoir viral. Quoi qu’il en soit, nous sommes à l’aube de l’usage de ces techniques et de nombreuses questions restent encore posées, tels l’acceptation éthique de ces manipulations ou encore celle du coût et de la faisabilité à grande échelle de telles techniques.
« Perdus dans la translation : l’implémentation de la PrEP et les personnes transgenres » par Asa Radix, USA
Est-il utile de rappeler les définitions : le sexe tel qu’assigné à la naissance l’est essentiellement sur un critère biologique et le genre est la perception que la personne a d’elle-même, telle qu’elle s’établit dans la prime enfance. C’est à partir de là que se définit la population transgenre comme un ensemble de personnes dont le genre est différent de leur sexe assigné à la naissance. On estime à environ 25 millions le nombre de personnes transgenre dans le monde, 0,4% de la population aux Etats Unis, 0,6% à 0,9% en Europe (UK, Belgique, Pays Bas). La stigmatisation et la discrimination dont sont victimes les personnes trans existe partout au monde avec plus ou moins d’intensité selon la capacité des états à imposer le respect d’autrui. Le site internet transrespect.org renseigne sur ces données dans le monde. Ce qui est remarquable lorsqu’on observe les données de l’épidémie de VIH c’est de s’apercevoir que les trans ne sont jamais comptabilisés en tant que tel alors que de plus en plus d’études nichées ont montré que ce sont des personnes particulièrement vulnérables à la maladie. Laverne Cox disait à ce propos en 2015 : « quel message envoie-t-on aux jeunes personnes trans et non conformistes de genre lorsqu’on ne les compte même pas ? On suggère que leurs identités n’ont pas d’importance ».

Une méta-analyse portant sur 39 études couvrant 15 pays estime la prévalence du VIH chez les femmes transgenres à 19,1% (Lancet ID 2015). Plusieurs études chez les hommes trans situent cette prévalence entre 4% et 10% mais c’est une question de dénominateur. Toujours est-il que ces résultats situent les personnes trans clairement dans la fenêtre des critères d’application de la PrEP. Les sous-études d’efficacité de la PrEP, notamment dans l’essai iPrEx (14% de femmes trans) ont montré des résultats comparables aux données générales si ce n’est une perte d’efficacité due à une moindre observance ou des interactions avec les traitements hormonaux. Il faudrait donc plus d’études pour mieux documenter la question. Ce qu’il faut retenir c’est que les personnes trans connaissent un risque disproportionné au VIH, que leur accès aux outils de prévention n’est pas à la hauteur notamment à cause de la discrimination, que les données épidémiologiques et cliniques manquent à leur sujet. Il est nécessaire de développer des structures de soin mieux adaptées et respectueuses des personnes trans à l’image du centre Tangerine de Bangkok et de mieux étudier et comprendre les raisons sociales et structurelles qui fondent leur vulnérabilité.
Mardi, session TUPL01
« Le rôle du microbiome dans la transmission et la physiopathologie du VIH » par Kevin Osborne, Canada
Le microbiome désigne l’ensemble des micro-organismes qui vivent sur toutes les surfaces, externes et internes, du corps. Cet ensemble représente dix fois plus de cellules que les cellules du corps lui-même, cent à mille fois plus de gènes que ceux de nos propres cellules et pèse au moins autant que le foie. La diversité de sa composition de ce microbiome est un signe de santé. Il peut être influencé par beaucoup de choses, ce que l’on mange, l’environnement et les conditions de vie, les agents extérieurs, les médicaments… En matière clinique on distingue un microbiome sain de celui associé à la maladie, essentiellement au niveau intestinal. Le cancer, le diabète, l’obésité ou les maladies cardio-vasculaires par exemple, déterminent des compositions particulières. Il en est de même pour les femmes enceintes. Nous nous intéresserons ici particulièrement au microbiome intestinal et vaginal.
La paroi intestinale des personnes séropositives au VIH est fréquemment le siège de phénomènes inflammatoires dus à une porosité accrue.
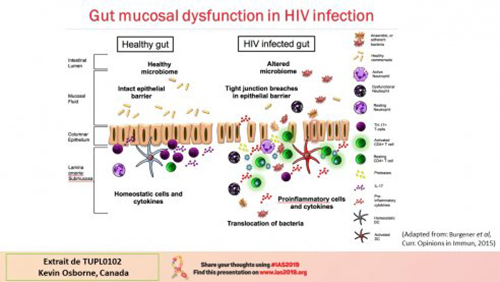
Il en résulte un passage de bactéries et une activité immunitaire intense et inflammatoire. Au niveau du microbiome, de nombreux facteurs influencent sa composition, l’infection à VIH en fait partie, mais cette composition est aussi influencée par l’activité sexuelle (différences entre HSH et non-HSH) et par d’autres comorbidités. On voit clairement chez les séropositifs un déficit de certaines bactéries plutôt bénéfiques et un excès d’autres plutôt inflammatoires. Quelques interventions ont été tentées, les régimes alimentaires, l’usage de médicaments pré- ou pro-biotiques, les transplantations de microbiote fécal notamment, avec des résultats plus ou moins encourageants mais dont les effets sont souvent limités à l’intervention.
Pour ce qui est du vagin, on distingue le microbiome sain à dominante de lactobacilles du microbiome dysfonctionnel dans lequel prolifèrent des bactéries plus ou moins pathogènes mais souvent inflammatoires. Elles sont la source de fragilité et de sensibilité accrue aux infections sexuellement transmissibles. Dans ce cas aussi, on observe avec l’infection à VIH une fragilisation de la muqueuse. Par ailleurs, la composition du microbiome vaginal influence l’efficacité des médicaments de la prophylaxie pré-exposition tel qu’on l’a observé dans les essais CAPRISA. Il est à noter que l’on observe souvent un microbiome vaginal dysfonctionnel dans les zones de forte endémie du VIH. Il existe quelques recommandations thérapeutiques pour les femmes mais elles ne résolvent pas forcément la question inflammatoire. Il est nécessaire de mener des études de recherche translationnelle pour résoudre ces questions de déséquilibre du microbiome tant pour les personnes VIH+ que pour celles à risque.
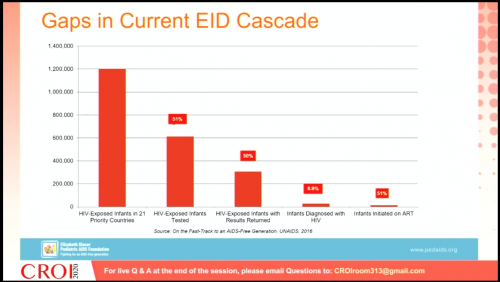
« Barrières dans l’accès au diagnostic et au traitement » par Ingrid Bassett, USA-Massachusetts
Dans cette présentation, il s’agit de s’intéresser au dépistage et au lien vers le soin, à savoir les deux premières cibles de l’objectif 90-90-90 de l’ONUSIDA.
De nombreux pays sont proches de la cible mais à certains endroits des efforts sont encore nécessaires. Quelles sont les principaux obstacles aux progrès sur ces points ? Les hommes sont dans la plupart des régions du monde moins souvent testés et traités plus tardivement que les femmes. C’est particulièrement vrai en Afrique, dans les Caraïbes, en Asie et Pacifique et en Europe de l’Est et Asie centrale. Tout cela est principalement dû aux normes sociales et causé par la perte de niveau social des séropositifs. Les adolescents (13 à 24 ans) sont une autre catégorie qui connait des obstacles majeurs autant pour l’accès au dépistage que pour le maintien dans les soins. Les principales raisons de ces difficultés sont la moindre perception du risque et la peur du rejet auxquels se rajoutent la difficulté d’accès aux offres de soins pour les mineurs incluant la question du consentement parental. A propos des populations clés, on note principalement un retard dans l’accès au dépistage et aux soins des travailleuses du sexe comparé à la population générale dans pratiquement toutes les régions du monde. Mais c’est aussi le cas des HSH, des personnes trans et des consommateurs de drogues.
L’obstacle principal pour beaucoup de gens est la stigmatisation et le refus de soins dans les lieux de soins médicaux. A cela s’ajoute parfois aussi le manque de confidentialité, voire la crainte que les usagers en ont. A ce titre rappelons que 67 pays criminalisent les relations sexuelles entre personnes de même sexe. Ces obstacles sont une véritable perte de chance et un risque aggravé de mortalité qui peut aller jusqu’à doubler, au-delà de 3 obstacles cumulés. En matière de solutions contre ces obstacles, le dépistage communautaire a certainement donné les meilleurs résultats partout où il a été développé. Mention spéciale pour les expériences de test à domicile, de développement de la distribution des autotests et des incitations au dépistage dans les applis de rencontre gays.
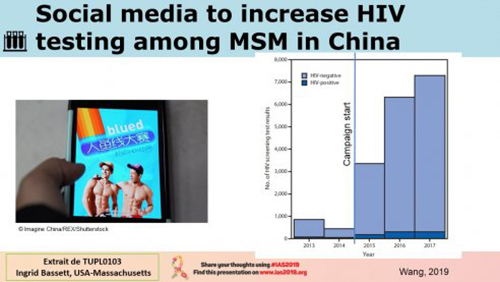
Autre mention remarquable, le développement de la notification assistée aux partenaires qui accroit l’efficacité du ciblage. Pour autant, le lien aux structures de soins n’est pas toujours aussi efficace dans les solutions plus allégées et il a clairement été démontrée par les expériences d’implémentation que seules les initiatives d’offres de dépistage qui incluent un dispositif de liaison au soin actif donnent des résultats qui ne sont pas inférieurs au dépistage classique. Les meilleurs exemples en la matière : le programme « Getting to zero » de San Francisco a permis de passer d’un délai entre dépistage et première visite de 8 jours en 2013 à 4 jours en 2017 et d’un délai entre première visite et mise sous traitement de 27 à 0 jours dans la même période. Et puis au Lesotho, le dispositif de test à domicile a vu le résultat de lien au soin considérablement amélioré par l’offre d’initiation au traitement à domicile le même jour. Et encore, la proposition aux travailleuses du sexe en Tanzanie d’une offre de dispensation des antirétroviraux dans un lieu communautaire de leur choix a considérablement amélioré le suivi par rapport à la dispensation classique. D’autres exemples d’intervention originale montrent que l’adaptation des services aux besoins des populations améliorent considérablement les résultats. Ces mêmes méthodes peuvent aussi être mises à profit pour récupérer des personnes perdues en cours de route par le système, une question dont on sait qu’elle n’a fait que s’accroitre ces dernières années. En faisant preuve d’imagination et de souplesse et en adaptant les solutions existantes aux besoins des gens, il est possible de ne laisser personne sans solution et d’accroitre le dépistage et le lien aux soins pour atteindre les objectifs de réduction de l’épidémie que nous poursuivons.
« Les populations clés d’Amérique Latine : les jeunes hommes ayant des relations sexuelles avec des hommes » par Carlos Fernando Caceres, Pérou
Dans cette présentation, Il sera question de jeunes gays et autres HSH, identitaires ou non, Entre 15 et 24 ans, latinoaméricains parlant portugais ou espagnol. Les données socio-épidémiologiques que nous avons sont celles de LAMIS, l’enquête internet menée après des HSH d’Amérique Latine menée en 2018 (65000 répondants, 18 pays) et imPrEP, une étude formative menée au Brésil, Pérou et Mexique en 2018, complété par les données ONUSIDA.
La prévalence du VIH, de 6,5% en moyenne chez les jeunes, tandis qu’elle est de 20% pour les plus de 25 ans, varie peu entre pays. Cependant si l’on regarde les nouveaux diagnostics des 12 derniers mois, la valeur selon l’âge est la même (3%), ce qui laisse entrevoir une résurgence de l’épidémie chez les jeunes. Cette progression est confirmée par d’autres données.

Par ailleurs, 9% des 18-24 ans ont eu une IST (syphilis, chlamydia ou gonocoque) dans les 12 derniers mois. Et pourtant, malgré ces données, la majorité (2/3 à 3/4) des jeunes se considère comme à faible risque. Selon LAMIS, la moitié des jeunes ont fait un test dans l’année précédente contre 2/3 pour les plus âgés. Une étude chez les adolescents (12 à 17 ans) au Pérou révèle une cascade de prise en charge à 73% dépistés, 75% sous traitement, 48% contrôlés, ce qui montre une large marge à couvrir pour atteindre les 90-90-90 espérés. Ce que montre LAMIS chez les jeunes gays, c’est une amélioration avec moins de binge drinking, plus de tests VIH, plus d’accès à l’information et aux services. Mais dans le même temps 24% d’augmentation de relations anales réceptives non protégées, 22% d’augmentation de l’usage de drogues, et une perception des risques faible en hausse de 25%. La connaissance de la PrEP varie entre 61% au Brésil et 37% au Pérou. Le recours au TPE n’est que de 2,4% chez les jeunes HSH pour 5% chez les plus âgés. Mais bien que l’usage de PrEP ne soit que de 0,6% chez les jeunes et 1,3% chez les plus âgés, données fortement influencées par une offre quasi inexistante, le désir d’accéder à la PrEP est le même à tous âges, entre 50% et 60%. La santé mentale est un autre sujet préoccupant. Selon LAMIS, 62% chez les jeunes vs 54% chez les plus âgés rapportent des symptômes d’anxiété ou de dépression depuis 2 semaines. De même l’idée de suicide est présente chez 36% des jeunes HSH contre 26% des plus âgés.
Les déterminants de ces problèmes sont à trouver dans les obstacles structurels que les mineurs et les autres jeunes HSH rencontrent pour se faire tester ou accéder à des services de santé sexuelle. Ils subissent la culture dominante très sexualisée facilitée par l’internet, favorisant une sexualité à partenaires multiples, changeant rapidement. Les politiques d’éducation sexuelle sont largement insuffisantes et incapables de faire face aux questions de ces jeunes. L’absence d’une communauté visible et stable au sein de laquelle les jeunes pourraient apprendre à faire des choix informés sur leur vie et leur sexualité, pèse d’autant plus que les rares interventions appropriées ou les programmes adaptés peinent à trouver un terrain de développement. Ce qu’il faut c’est supprimer tours les obstacles légaux absurdes auquel les mineurs se heurtent lorsqu’ils ont besoin de soins de santé sexuelle. Il faut aussi offrir une vraie éducation sexuelle qui fait sens, capable de répondre à toutes les questions des jeunes dans le contexte actuel. Il faut étendre l’accès à la prévention et aux soins en développant des services adaptés aux jeunes HSH incluant et développant un large accès à la PrEP. Il est essentiel d’empêcher la mainmise des intérêts commerciaux réduisant la communauté à un segment de marché. Une communauté doit permettre l’éducation de ses jeunes dans le respect des différences et permettre le développement d’une sexualité plus heureuse, plus complète, plus humaine.
Mercredi, session WEPL01
« Maintien des programmes VIH et financement de la réponse au VIH » par Sherrie Kelly, USA
De grands progrès ont été accomplis dans la lutte contre le sida, 1,7 millions de nouvelles infections en 2018, en recul de 16% par rapport à 2010 et 770 000 décès liés au sida soit 33% de moins qu’en 2010. Et pourtant nous n’atteignons pas les objectifs souhaités, moins de 500 000 nouvelles contaminations et moins de 500 000 décès en 2020. Pour y parvenir il faut investir plus et surtout mieux que ce que nous faisons actuellement. Il manquait 7,2 milliards de $ en 2018 pour atteindre les 25 milliards nécessaires au financement de la lutte contre le sida dans le monde selon l’ONUSIDA. Si l’objectif 2020 de l’ONUSIDA (90-90-90) est retardé de 5 ans (à 2025), cela se traduira par 2,1 millions de nouvelles contaminations et 1 million de morts en plus.
C’est pourquoi, notre groupe en coordination avec la Banque Mondiale a tenté de proposer des optimisations de répartition des financements à partir des projections proposées. Ainsi par exemple pour le Soudan, sur la base de la répartition des fonds de 2013, nous avons proposé une progression de 12% à 18% des dépenses de traitements, de 7% à 29% des programmes de prévention à destination des populations clés, et une réduction drastique des programmes de prévention en population générale. La réallocation adoptée pour 2015-2017, basée sur notre proposition mais en recul général de moyens d’environ 16%, a permis une réduction de 49 000 nouvelles infections (-33%) et 14 000 décès (-22%) par rapport à ce qui aurait eu lieu avec le maintien de l’allocation financière de 2013.
Il est même possible de faire mieux en optimisant encore l’utilisation des ressources selon les analyses des territoires et les modalités de services. Nous avons fait ce travail pour environ 50 pays en projection pour 2030. Nos principales recommandations sont de renforcer les dépenses pour les traitements de 44% à 53%, les programmes de prévention des populations clés, les programmes de réduction des risques. A l’inverse, les réductions préconisées sont surtout sur les programmes de prévention à destination de la population générale surtout dans des contextes d’épidémies concentrées.
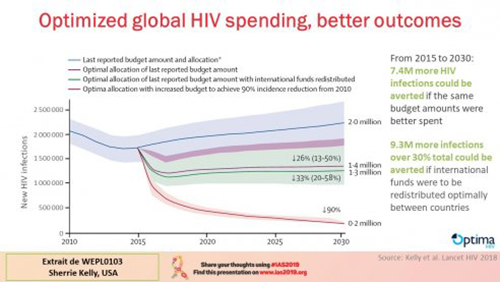
Nos estimations sont de pouvoir éviter 7,4 millions de nouvelles infections à budget constant. Ce chiffre pourrait passer à 9,3 millions si les financements internationaux étaient distribués de manière mieux optimisée entre les pays. Les clés pour mieux faire ? Financer les interventions les plus efficaces et les mieux adaptés à chaque situation, cibles les personnes les plus vulnérables, agir sur les lieux les plus affectés (analyse géospatiale), adopter les meilleurs stratégies (achats, coûts induits, réductions d’échelle, intégration à la couverture universelle). Pour autant, les modèles peuvent inclure des programmes moins performants mais éthiquement justifiés. Pour sauver plus de vies et prévenir plus d’infections, il faut faire des choix de dépenses à l’efficacité démontrée et refuser des intervention dont l’effectivité n’est pas suffisante.
« Infection primaire au VIH : une opportunité à ne pas manquer » par John Frater, UK
L’un des défis les plus importants des années à venir est la réduction du délai entre contamination et diagnostic de l’infection à VIH. Pourquoi est-ce si important ? c’est ce que nous explique John Frater.
L’opportunité est un ensemble de circonstances qui rendent une action possible. En matière de VIH, l’infection aigue se situe entre la contamination et le début de la réaction immunitaire, stades Fiebig 1 et 2, l’infection précoce démarre après l’infection aigue jusqu’à environ 6 mois de la contamination, stades Fiebig 3 à 6, et l’infection primaire ou primo-infection c’est l’ensemble des deux autres, autrement dit, les six premiers mois qui suivent l’infection.
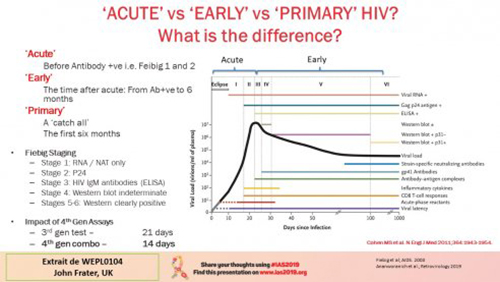
Il n’est pas facile de reconnaitre une primo-infection sur les seules manifestations cliniques, d’abord parce que la moitié d’entre elles est asymptomatique, ensuite parce que, pour les autres, les symptômes ne sont pas très spécifiques : fièvre et symptômes grippaux, maux de tête, diarrhée, rashs cutanés. C’est pourquoi, sans faire de test, on peut facilement passer à côté. De plus, aujourd’hui, il est nécessaire de tenir compte du contexte d’utilisation de la PrEP qui peut, lorsqu’elle est utilisée par des personnes déjà contaminées, masquer les vrais résultats. Le traitement de la primo-infection a des avantages décisifs :
1) il permet une meilleure et plus rapide reconstitution de l’immunité – retour des lymphocytes CD4 à la normale, reconstitution du rapport CD4/CD8 contrairement aux personnes traitées plus tardivement. Lorsqu’on étudie en détail l’évolution de nombreux paramètres au cours du traitement de la primo-infection, on constate que ce qui ne revient pas ce sont des marqueurs d’activation de lymphocytes T CD8, d’activation immune, en particulier CD38, Tim-3 et PD-1.
2) il réduit le risque de transmission du virus – 40% des nouvelles contaminations sont le fait de personnes en primo-infection non traitée. Il s’agit donc principalement d’un avantage de santé publique. Mais l’objectif international 95-95-95 en 2030 n’est atteignable qu’en traitant le plus tôt possible au cours de la primo-infection. Une modélisation du traitement immédiat de toute nouvelle infection montre qu’on réduit la transmission à 89% chez les HSH.
Quel potentiel nouveau apporte le traitement en primo-infection ? Il permet la réduction de l’activation immunitaire et de son épuisement. Il prévient l’extension du réservoir viral. Les études sur le sujet ont montré que l’état du réservoir au bout d’un an de traitement dépend de son état au départ. Le fait de traiter tôt permet de limiter l’extension du réservoir rapidement. Le traitement en primo-infection permet aussi de mieux préserver l’immunité spécifique anti-VIH qui est la première cible du virus et il prévient mieux le risque d’échappement viral au traitement. Tous ces avantages du traitement en primo-infection du VIH montrent l’importance du dépistage sans lequel rien n’est possible.
Archives :
Pour approfondir un sujet, toutes ces sessions sont visibles en webcast à partir du site de l’IAS dédié en recherchant la session désirée (elles sont en anglais, la langue de la conférence).
