DOSSIER THÉMATIQUE : PrEP
Comprendre la prophylaxie pré-exposition ou PrEP
Juin 2010 : Lorsque des chercheurs se lancent dans un projet de recherche en prévention de la transmission du VIH, ils se doivent de consulter la communauté visée par l’essai en invitant ses représentants à participer à leurs travaux. Dans le processus de construction de l’essai français IPERGAY de PrEP, c’est bien ce qui est en train de se passer. Mais pour bien tenir ce rôle de représentant, il est souhaitable d’entendre les avis qui émergent de ceux que l’on représente. Encore faut-il qu’ils s’expriment. Sur un sujet technique et complexe comme celui de la PrEP, il faut d’abord s’informer et comprendre le fond du problème avant de commencer à se faire une idée.
Décembre 2010 : En publiant les résultats définitifs, l’essai iPrEx démontre la première fois l’intérêt du Truvada en PrEP pour les gays.
Janvier 2011 : Le groupe interassociatif TRT-5 qui a représenté auprès des chercheurs la communauté concernée par le projet de recherche français depuis deux ans a souhaité accélérer le mouvement de réflexion en mettant en place un processus de consultation communautaire sur le sujet des PrEPs. C’était une première étape, essentielle mais non exhaustive. Elle s’est terminée par la remise d’un rapport de consultation communautaire aux promoteurs et investigateurs de l’essai IPERGAY.
Janvier 2012 : L’essai français IPERGAY inclut ses premiers volontaires
Septembre 2012 : L’autorité américaine du médicament, la FDA approuve l’usage du Truvada en PrEP aux États-Unis. Le comité scientifique d’IPERGAY rappelle l’importance du placebo dans l’essai.
Octobre 2014 : À deux semaines d’intervalle, les phases de test des essais britanique PROUD et français IPERGAY sont interrompus pour cause d’efficacité prouvée ! Tous les participants reçoivent désormais la PrEP.
Juin 2015 : depuis la création de ce dossier, pas mal de temps a passé et les derniers résultats publiés cette année confirment l’intérêt de la prévention biomédicale et de la PrEP.
L’année 2015 sera décisive pour la mise en œuvre de la PrEP en France.
Le débat a vocation à se poursuivre. La rédaction de Reactup.fr entend y contribuer dans toute la mesure de ses possibilités en vous offrant toutes les informations dont vous avez besoin pour vous faire vous aussi votre idée sur la PrEP.
1. De l’idée de PrEP à l’essai français

1. Cette présentation a été utilisée comme source d’information générale sur la PrEP lors des rencontres organisées dans le cadre de la consultation communautaire sur le projet de recherche français PrEP initié par le groupe interassociatif TRT-5 de février à juillet 2010. Elle était destinée à compléter les connaissances des participants à ces rencontres sur le concept de PrEP et l’état des recherches la concernant.
Origine de la PrEP

2. L’idée d’utiliser des antirétroviraux en prévention n’est pas récente.
Parmi les modes de transmission du VIH, la transmission materno-fœtale ou transmission mère-enfant est connue et décrite depuis les premières années de l’épidémie, avant même l’apparition des premiers antirétroviraux. Pour la combattre, l’idée est venue rapidement aux chercheurs lorsqu’a commencé l’utilisation de l’AZT apparu en 1986, le premier antirétroviral.
Les travaux des spécialistes ont abouti en 1994 aux conclusions de l’essai ACTG076 (États-Unis) / ANRS024 (France) de réduction de la transmission mère-enfant par l’utilisation de l’AZT. La transmission qui est naturellement de 25% à 30% chutait à 5% par l’administration d’AZT à la mère avant et pendant l’accouchement.
À ce jour, l’amélioration de ces techniques notamment grâce à l’emploi de trithérapies et d’un traitement temporaire des enfants a permis de réduire encore ce risque qui se situe en dessous de 1% dans les pays occidentaux.

3. À la même époque, des scientifiques français, anglais et américains s’associaient pour un autre programme d’étude portant sur le risque de transmission par exposition au VIH lors d’accidents professionnels. Autrement dit, ils s’intéressaient aux accidents d’exposition au sang des personnels soignants prenant en charge des personnes vivant avec le VIH qui, dans leur pratique, avaient pu être blessés par exemple par une aiguille ou un scalpel ayant servi pour pratiquer un acte sur un séropositif.
Le principe de cette étude était de recenser le plus largement possible tous les cas connus afin de mesurer quel était le risque de transmission. Or il est apparu dans le recueil de ces données que certaines personnes avaient tenté de limiter le risque de transmission en se basant sur le principe utilisé dans la prévention de la transmission mère-enfant, c’est-à-dire en prenant de l’AZT à la suite d’un tel accident.
En comparant les données de transmission de ces deux groupes de gens, ceux qui avaient pris de l’AZT versus ceux qui n’en avaient pas pris, les chercheurs ont conclu à une réduction de 80% de la transmission par l’usage d’AZT post-exposition.

4. Sans tarder, les résultats de l’étude franco-anglo-américaine ont été traduits en France par une recommandation officielle du Ministère de la Santé aux professionnels du soin sous forme d’une note d’information (n°666 du 28 octobre 1996) publiée dans le bulletin épidémiologique hebdomadaire de décembre 1996. Cette note précise la conduite à tenir en cas d’accident d’exposition au virus chez les professionnels de santé lors d’actes de soins prodigués à des séropositifs. Elle recommande l’emploi d’AZT comme traitement de prophylaxie post-exposition afin de réduire le risque d’acquisition de l’infection.
Également sans tarder, plusieurs associations de lutte conte le sida ayant eu connaissance de ce texte se sont inquiétés de ce que cet outil de prophylaxie soit réservé aux seuls accidents professionnels alors qu’il apparaissait évident que la différence avec d’autres accidents d’exposition n’avait pas de justification. Autrement dit, un préservatif qui craque ou tout autre accident d’exposition auquel tout un chacun pouvait être soumis pouvait faire l’objet de la même meure. Dans diverses publications, les associations (AIDES dans le bulletin REMAIDES, Act Up Paris dans un encart publié dans le quotidien LIBÉRATION) conseillaient aux personnes dans ce cas de se rendre aux urgences de l’hôpital le plus proche pour réclamer ni plus ni moins que ce qui était préconisé aux professionnels.
C’est ainsi que naquit le principe du TPE ou Traitement Post-Exposition, encore appelé PEP (prophylaxie post-exposition, en anglais Post-Exposure Prophylaxis).

5. Le principal problème posé par l’apparition du résultat sur le TPE était qu’il semblait difficilement concevable sur le plan éthique de mener a posteriori des recherches randomisées (placebo avec tirage au sort) susceptibles de démontrer rationnellement le résultat obtenu. Pour autant, il fallait bien essayer d’acquérir un peu plus de connaissances et de rationalité à ce résultat. Il fut donc procédé à des expérimentations animales dont l’étude de Tsai et collègues publiée fin 1995 dans « Sciences ». Cette étude reste encore aujourd’hui le socle sur lequel est basé le protocole de traitement post-exposition. Elle montre en effet une chose particulièrement importante, le fait qu’il y a un délai après l’exposition au-delà duquel la prophylaxie n’a plus d’effet. Par précaution, il fut décidé que ce délai devait être fixé à 48 heures et que le traitement devait durer un mois chez les humains et être composé d’une trithérapie afin de ne pas risquer l’apparition de virus résistant à cause de l’insuffisance de puissance du traitement.
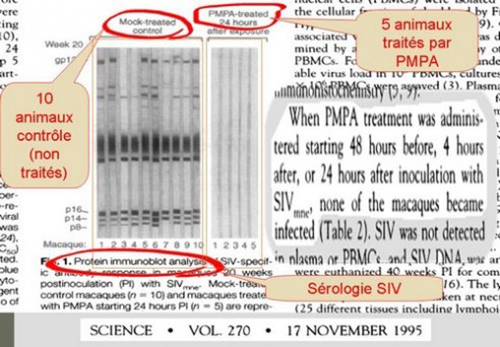
6. Le produit utilisé dans cette étude était le PMPA, plus connu aujourd’hui sous le nom de tenofovir. Sur cette feuille de résultats on voit le résultat d’un test de sérologie pratiqué sur les animaux qui montre bien que les 5 animaux traités par PMPA sont totalement exempts de trace de protéines virales alors que les dix animaux non traités sont tous contaminés.
Mais cette recherche a été un peu plus loin que seulement l’étude de la prophylaxie post-exposition. Les chercheurs ont tenté de vérifier ce qui se passait lorsque le traitement était administré avant l’exposition au virus. Ils ont ainsi montré que les animaux n’étaient pas contaminés dans ces conditions d’expérience si le traitement était administré jusqu’à 48 heures avant l’exposition des animaux au virus. Il ne s’agissait plus là de prophylaxie post-exposition mais de prophylaxie pré-exposition, de PrEP (en anglais Pre-Exposure Prophylaxis).Autrement dit : la prise d’un traitement antirétroviral pris avant une exposition au VIH pourrait prévenir le risque d’infection.

7. Actuellement, les recherches chez le macaque se poursuivent afin d’affiner les modalités d’utilisation possible. Une équipe américaine est particulièrement active dans ce domaine et multiplie les résultats depuis quelques années, l’équipe de Gerardo Garcia-Lerma aux États-Unis.
Elle s’est intéressée en particulier à l’utilisation de différents médicaments, le tenofovir, l’emtricitabine, la combinaison de ces deux produits mais aussi de différents modes d’administration, par voie orale ou en injection, ou de différentes doses.
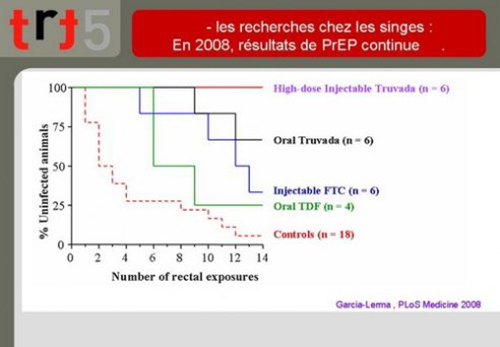
8. L’équipe de Garcia-Lerma a ainsi publié en 2008 le résultat de l’efficacité de différentes solutions de PrEP administrées en continu chez des macaques que l’on soumet à des expositions répétées à un virus humanisé de singe appelé le SHIV.
On voit sur ce graphique de résultats que :
- 3/4 des animaux contrôles (qui ne reçoivent pas de traitement) sont infectés au bout de 4 expositions alors qu’il faut 9 expositions pour obtenir la même chose chez les animaux recevant du tenofovir par voie orale (oral TDF),
- L’emtricitabine par injection (injectable FTC) donne un résultat un peu meilleur,
- Le truvada (combinaison de tenofovir plus emtricitabine) protège près de 70% des animaux après 14 expositions,
- Un traitement par forte dose de truvada en injection protège tous les animaux après 14 expositions.
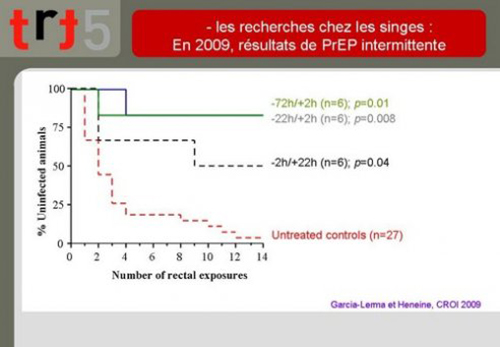
9. En 2009, la même équipe a publié des résultats d’un usage intermittent de PrEP. Il s’agissait de s’intéresser à l’idée d’un usage non plus continu du traitement prophylactique mais plutôt adapté à une période d’exposition.
Ce que ces résultats montrent, c’est que :
- La meilleure protection est assurée par une prise de traitement suffisamment éloignée de l’exposition (72 heures à 22 heures avant) et une prise rapidement après l’exposition (2 heures)
- Un traitement trop rapproché de l’exposition au virus protège moins bien
D’autres résultats de cette équipe de recherche ont été publiés depuis, précisant encore davantage ces modèles.
Réduire la transmission sexuelle du VIH
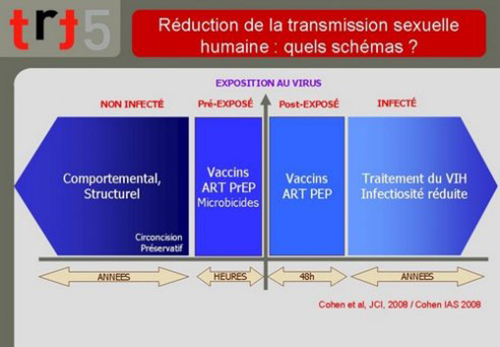
10. La réduction de la transmission du VIH chez les humains pourrait-elle bénéficier de ces recherches ? C’est ce qui reste à démontrer.
Rappelons-nous que les outils dont nous disposons pour la prévention de la transmission du VIH peuvent se classer en quatre parties selon ce modèle proposé par le Pr. Myron Cohen décrivant le moment où elles interviennent par rapport à l’événement de transmission:
- Les interventions comportementales ou structurelles visant les séronégatifs parmi lesquelles on peut classer le préservatif ou la circoncision. Elles nécessitent une mise en œuvre longtemps avant la possible transmission pour être efficaces ;
- Les interventions biomédicales à base d’antirétroviraux et possiblement les techniques vaccinales peuvent être efficaces à une distance de la transmission qui se comptent en heures qui précèdent ;
- Les interventions possibles dans les heures qui suivent la transmission ;
- Les interventions susceptibles de réduire la transmission chez les personnes déjà infectées.
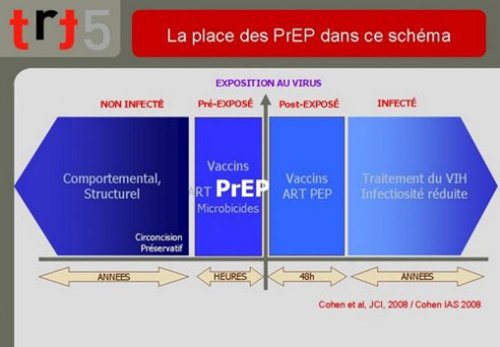
11. Parmi tous ces modes d’intervention, on aura aisément situé le champ de la PrEP : dans les heures qui précèdent la transmission.
Cela signifie essentiellement que la PrEP est un moyen de prévention par anticipation, autrement dit, qu’il nécessite la conscience du risque à venir de la part de son utilisateur.
Aujourd’hui, le concept de PrEP désigne aussi bien l’usage d’une prise d’antirétroviraux par voie orale, sous forme de comprimés, que l’application locale de gels d’antirétroviraux. On parle alors de PrEP orale ou systémique (diffusion dans tout le corps) ou de PrEP « topic », anglicisme désignant une application locale.
La PrEP testée chez l’humain

12. D’autres questions se posent lorsque l’on veut essayer une prophylaxie pré-exposition chez les humains. Parmi celles-ci, le choix du traitement est essentiel. Parmi les questions qui se posent, en voici les principales :
- Devant être utilisé par des personnes non malades, il faut que la facilité et le confort d’utilisation soient maximaux. Il est ainsi difficilement envisageable d’avoir recours à des injections ou à des prises de médicament trop contraignantes.
- Mais il faut surtout que le traitement proposé soit tolérable, autrement dit, exempt d’effets secondaires intolérables, notamment si l’on imagine que le risque à éviter se situe lors de rapports sexuels. On ne pourrait ainsi pas imaginer un médicament qui indispose les personnes.
- Tant qu’à protéger, autant que le traitement le soit contre tous les types de VIH. Ce serait même mieux d’imaginer que des PrEP protègent aussi contre d’autres infections sexuellement transmissibles.
- Compte tenu de la question de l’anticipation nécessaire, il est souhaitable d’avoir un produit auquel on puisse avoir recours à distance assez rapprochée des rapports sexuels.
- Le risque majeur identifié jusque là dans cette technique est celui de sélection de résistance. En effet, si, malgré l’usage du traitement, le virus vient à infecter la personne, les antirétroviraux ne présentent pas forcément une puissance suffisante pour limiter la réplication virale. Entre l’infection et la séroconversion permettant un dépistage positif, le temps qui s’écoule peut permettre au virus d’échapper aux antirétroviraux par des mutations lui conférant une résistance à ces traitements. Cela pourrait compromettre les options thérapeutiques de la personne ainsi contaminée. Les performances du traitement choisi en matière d’induction de résistance sont donc essentielles.
- Tant qu’il s’agit d’expérimentation, la question du prix reste secondaire. Mais il ne faut pas oublier cette dimension lors de l’expérimentation si l’on veut disposer un jour d’une technique abordable quelle que soit la solution adoptée pour son financement.
Le produit actuellement le plus testé est truvada, combinaison de tenofovir et d’emtricitabine commercialisé par la firme GILEAD
L’expérimentation humaine est réalisée en plusieurs étapes. La première, les essais de phase I permettent d’en apprécier la tolérance, autrement dit, de vérifier que le traitement proposé n’est pas délétère.
Une fois que c’est acquis, il convient d’en tester l’efficacité, autrement dit, de vérifier que l’effet recherché est bien réel au niveau individuel.
Plus tard, il faudra s’intéresser à l’efficience, c’est-à-dire vérifier qu’à l’échelle d’une population, la technique garde son efficacité.
Dans les essais de tolérance et d’efficacité, la technique employée consiste essentiellement à mener des essais dits randomisés contre placebo. Cela signifie qu’on va recruter des participants, les séparer en deux groupes par tirage au sort puis donner à un groupe des comprimés de produit actif et à l’autre groupe des comprimés similaires mais sans activité (le placebo). Les résultats s’expriment alors en différence observée entre les deux groupes. Ces résultats ainsi obtenus peuvent ensuite être consolidés ensuite par des observations supplémentaires sans recours à la comparaison au placebo.

13. Les essais de PrEP chez les humains ont démarré au début 2004 dans le monde. Les premiers essais ont été destinés à étudier la tolérance du tenofovir dans différentes populations. Les essais africains ont essentiellement recruté des femmes, l’essai thaïlandais, des usagers de drogue et des gays, l’essai américain, des gays.
Les premiers essais d’efficacité dont on a obtenu les résultats sont l’essai CAPRISA 004 d’un gel à application vaginale pour les femmes en Afrique du Sud et l’essai iPrEx, essai international de truvada en continu (un comprimé par jour), recrutant des gays sur 5 continents.
D’autres essais ont démarré. Ils concernent notamment des couples hétérosexuels sérodifférents et différentes techniques de PrEP.
L’essai franco-canadien promu par l’ANRS est programmé pour l’année 2011. Il se propose de tester un traitement prophylactique par voie orale intermittent chez des gays.
Ce calendrier ne comporte pas les essais de gel microbicide à usage rectal qui ont commencé très récemment.
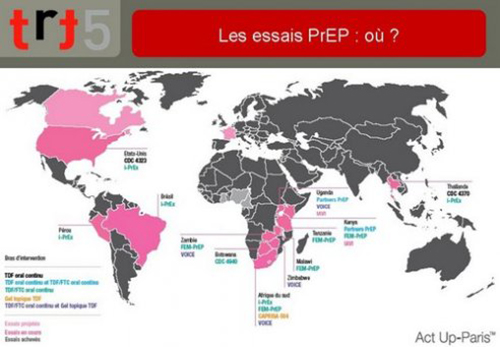
14. Cette vue permet de se rendre compte de la diversité des territoires où les recherches de la vue précédente ont eu lieu.

15. Le premier résultat publié d’un essai de PrEP concerne un essai de tolérance d’une prophylaxie orale. Il a été obtenu par l’étude West Africa menée au Ghana, au Cameroun et au Nigeria avec 936 femmes ayant testé le tenofovir en une prise quotidienne entre juin 2004 et mars 2006. Parmi les conclusions de cette étude, il est à noter particulièrement :
- L’essai s’est conclu sans avoir constaté d’effet indésirable sérieux. Certaines intolérances ont été constatées sans qu’elles aient donné lieu à des interventions et sans être certain qu’elles étaient liées à l’usage du produit.
- Il n’a pas été constaté de compensation du risque. Explications : dans tout essai de prévention biomédicale de ce type, même lorsque l’objectif n’est que la mesure de la tolérance, il est nécessaire d’évaluer les comportements de prévention des participants (usage de préservatifs principalement) et de mesurer leur évolution afin de savoir si les participants ont modifié leur comportement notamment en présumant de l’effet possible de ce qu’ils testent. Dans le cas d’essais de tolérance ou d’efficacité, il est souhaitable de ne pas constater ce type de compensation puisque la technique est expérimentale et que si les personnes se sentaient protégées, ce pourrait être un leurre. Tout dépend ici de la manière dont ils ont été accompagnés dans le cadre de la recherche qui se doit non seulement de vérifier qu’il n’y a pas de fausses perception de protection mais surtout d’informer clairement et précisément les personnes sur les risques encourus dans la recherche.
- Enfin, les huit séroconversions, deux dans le groupe ayant reçu du tenofovir, 6 parmi celles qui avaient un placebo, sur 936 participantes, même si leur répartition a l’air d’indiquer une tendance, ne marquent pas une différence suffisamment significative pour faire la différence entre un effet du hasard et une réelle protection due à la technique utilisée.
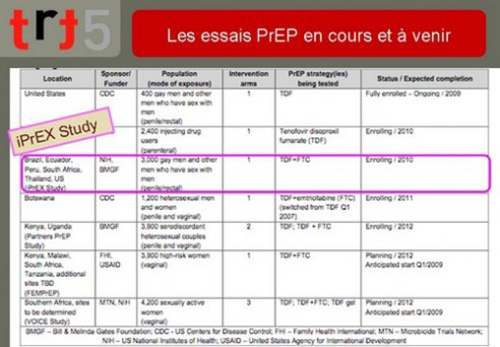
16. Le calendrier des essais en cours ou à venir (au moment de la consultation communautaire, c’est-à-dire au premier semestre 2010) permet de se rendre compte de la diversité des recherches et des populations. Il permet aussi de constater la fusion de plus en plus régulière des techniques orales et topic ainsi que de l’utilisation généralisée de « truvada », association de tenofovir et d’emtricitabine.
L’essai iPrEx dont les premiers résultats ont été rendus publics en fin d’année 2010 est souligné.

17. Les premiers résultats de l’essai iPrEx ont été rendus publics au-delà de la consultation communautaire. Ils constituent une avancée sérieuse dans le calendrier d’étude des PrEP puisqu’il s’agit des premières conclusions sur l’efficacité de cette solution de prévention biomédicale.
De plus, ayant été organisée pour recruter des gays, ses conclusions étaient particulièrement attendues par les investigateurs du projet français comme par toute la communauté gay, particulièrement en France et au Canada, puisqu’elle est visée également par le projet français.
L’essai français de PrEP : IPERGAY

18. Examinons maintenant le projet français dans ses grandes lignes.
Il est en construction depuis 2008 sous la conduite de l’investigateur principal, le Pr. Jean-Michel MOLINA, chef du service des maladies infectieuses à l’hôpital Saint-Louis à Paris et président de l’action coordonnée n°5 de l’ANRS (en charge de la sélection des projets de recherche clinique dans le VIH). Si son champ d’action a plutôt été la recherche clinique jusque là, il a décidé de s’intéresser à cette recherche biomédicale en prévention en s’entourant d’une équipe riche de spécialistes de toutes disciplines nécessaires à la réussite du projet : cliniciens, virologues, pharmacologues, chercheurs en sciences humaines et sociales, chercheurs en économie de la santé. Il a également confié au SC10, l’un des services de méthodologie de recherche les plus anciens et les plus habitués à la recherche sur le sida, le soin de s’occuper de tout l’aspect méthodologie et bio-statistiques du projet. Il a aussi sollicité le groupe interassociatif TRT-5 ainsi que les associations canadiennes de lutte contre le sida pour participer à la réflexion sur cette recherche. Il a obtenu le concours de l’association AIDES, à travers l’activité de sa mission sur la recherche, qui sera un des opérateurs du projet.

19. Il s’agit d’un essai défini comme devant comparer l’efficacité préventive contre l’infection par le VIH d’une combinaison tenofovir et emtricitabine, soit truvada (TDF/FTC), à un médicament sans effet (versus placebo). La répartition des participants entre les deux groupes (ou bras), celui recevant truvada ou celui recevant le placebo, se fera par un tirage au sort (Essai randomisé) dont le résultat ne sera connu ni des participants ni des investigateurs (en double aveugle) pendant toute la durée de l’essai. Tous les participants bénéficieront pendant toute la durée de l’essai d’un certain nombre de dispositifs de prévention classique (mise à disposition de préservatifs, entretiens de conseils en prévention, tests de dépistage, entretiens motivationnels à la demande, etc…) comme il est recommandé dans toute recherche de ce type par les standards internationaux.
Le résultat principal de l’essai sera exprimé comme la différence entre le nombre de personnes contaminées par le VIH dans le bras truvada et le bras placebo, exprimé comme l’incidence de l’infection, à savoir le nombre de nouveaux cas par an.
Combien faut-il recruter de personnes pour monter un tel essai de manière à obtenir un résultat significatif (suffisamment marqué pour qu’on ne puisse pas dire qu’il est dû au hasard) ? Les biostatisticiens utilisent pour cela une hypothèse de résultat (50% d’efficacité, autrement dit moitié moins de contaminations avec truvada que sans) et une marge d’incertitude sur ce résultat pour calculer combien de personnes doivent se prêter à la recherche et combien de temps pour obtenir ce résultat. Dans le cas de cet essai, ils ont calculé qu’en recrutant une population dans laquelle l’incidence est de 3% par an (trois nouvelles infections par an dans une population de 100 personnes), il faudrait 1800 participants inclus chacun pendant deux ans (900 dans le bras truvada et 900 dans le bras placebo) pour y parvenir.
Il s’agit probablement de l’aspect le plus critique de la construction scientifique de l’essai. En effet, les données de surveillance épidémiologique actuelles montrent une incidence de 1% par an dans ce qu’on estime (selon la dernière enquête sur la sexualité des Français) être les gays (ou HSH pour les scientifiques, hommes ayant des relations sexuelles avec d’autres hommes). La recherche PREVAGAY menée par l’InVS en 2009 pour mesurer l’incidence dans la population fréquentant des établissements affichés comme gays du centre de Paris a donné un résultat nettement plus élevé (entre 4% et 8% probablement, la valeur initiale faisant actuellement l’objet d’une révision), les investigateurs estiment qu’en sélectionnant des individus considérés comme potentiellement plus à risque, on peut obtenir la valeur de 3% attendue pour la population recrutée (voir plus loin, critères d’inclusion). Les pays occidentaux étant assez semblables sur le plan épidémiologique, ces hypothèses sont raisonnablement extrapolables à d’autres participants comme les Canadiens.
Ces hypothèses permettent également bien de comprendre que, dans les pays occidentaux, la seule population que l’on puisse recruter pour un tel essai pour obtenir un résultat avec un nombre de participants qui reste limité est la population gay. Avec une incidence beaucoup plus faible, il faudrait beaucoup plus de participants pour faire la même démonstration ce qui compromettrait la faisabilité d’une telle recherche, tant pour une raison de coût évidente mais aussi parce que le recrutement nécessaire pourrait ne pas être atteint.
Mais il faut aussi prendre en compte le fait que, dans le contexte épidémiologique des pays occidentaux, la question de la forte incidence de l’infection par le VIH dans la communauté gay est un problème majeur qui peut justifier une mobilisation des chercheurs sur un outil comme la PrEP plus que dans un autre segment de population.

20. De tout ce qui vient d’être dit, on tire aisément les critères de sélection des participants :
- Homosexuel masculin de plus de 18 ans
- Risque élevé de contaminations par le VIH (rapports anaux, non systématiquement protégés, partenaires multiples)
- Absence d’infection par le VIH
Les critères définissant le risque élevé ont été sélectionnés à partir des résultats d’études comportementales qui les ont désignés comme les caractéristiques les plus significatives de la prise de risque.
D’autres critères, d’ordre médical, sont destinés à s’assurer que les participants ne seront pas exposés à un risque aggravé de santé dans cet essai compte tenu des connaissances et des incertitudes actuelles. Ils n’ont pas tous été inclus dans la liste présentée ici.
Enfin, la nature de l’essai et sa conduite suppose une relation étroite entre les participants et les investigateurs, là encore pour des raisons de sécurité des participants. D’où le critère : « Contact possible par téléphone et/ou e-mail »

21. Mais la particularité principale de ce projet de recherche par rapport aux autres essais passés est de proposer un traitement « à la demande ». Il s’agit de considérer que la prophylaxie, contrairement à un traitement, n’est nécessaire aux personnes qu’en cas de risque d’exposition au virus. Dès lors, la prise d’antirétroviraux n’est pas forcément nécessaire en continu ni facile à accepter par les personnes qui n’en ressentent pas le même besoin que lorsqu’il s’agit d’un traitement. L’idée de n’utiliser une PrEP que lorsqu’on éprouve le besoin de se prémunir contre un risque d’exposition pourrait faciliter son usage. Encore faut-il savoir comment s’y prendre, d’où le besoin d’une recherche spécifique.
L’usage d’un placebo dans une telle recherche est justifié par les standards de recherche biomédicale comme permettant de fournir une comparaison entre une stratégie testée et une stratégie standard sans que les participants puissent être influencés par le choix de cette stratégie. Il faut bien remarquer que, dans cet essai, la stratégie comportant le truvada est comparée à une stratégie standard de prévention comportementale et non pas à rien. Deux remarques sont nécessaires à ce propos :
- L’inquiétude majeure de ce genre d’essais étant une possible compensation du risque – le fait que les personnes, présumant de la protection que peut leur apporter le médicament, relâchent leurs précautions habituelles – lorsque les participants ne sont pas certain de bénéficier du médicament du fait de l’emploi de placebo et du tirage au sort en double aveugle, leur propension à changer leurs comportement s’en trouve grandement réduite. À condition, bien sûr, à ce que tout le processus leur ait bien été expliqué, voire régulièrement répété, ce qui a été prévu par les investigateurs.
- Ce qui est considéré dans l’essai comme le « standard de prévention » est en fait bien supérieur à ce qui est couramment proposé en dehors d’un essai puisque l’ensemble du dispositif de prévention prévu pour les participants ainsi que la haute teneur en accompagnement de santé peut facilement être qualifié de plus haut niveau d’accompagnement de prévention possible.
C’est bien ainsi que l’accompagnement des participants tout au long de la recherche a été construit. Le suivi biomédical prévu tous les deux mois comporte avant tout un dépistage de l’infection par le VIH. Cette fréquence est rendue nécessaire afin de minimiser le risque de développement de résistance par le virus chez une personne qui serait contaminée par le VIH en présence de truvada puisqu’il s’agirait là d’un traitement sub-optimal de l’infection. En plus du dépistage et des conseils préventifs, le suivi dans l’essai devra comporter une surveillance des risques d’infection sexuellement transmissibles ainsi que leur prise en charge en cas de besoin. Enfin, le meilleur standard de prévention sera appliqué jusqu’au bout de sa logique puisqu’en cas de risque de contamination avéré, les participants pourront avoir recours à un traitement post-exposition qui, bien entendu, suspendra pour sa durée la poursuite de la PrEP.

22. Lorsqu’un tel projet de recherche est monté, il donne l’occasion aux chercheurs de résoudre bien d’autres interrogations que seulement la question principale qui a défini le projet. C’est aussi ce que les investigateurs de ce projet on prévu. Cela inclut évidemment un ensemble de questions destinées à renforcer les connaissances déjà acquises à propos de la tolérance du produit employé. Mais surtout, si l’on veut être capable d’interpréter correctement le résultat principal de l’essai, il est nécessaire d’étudier l’observance, autrement dit, la rigueur avec laquelle les participants ont respecté l’usage prévu du médicament utilisé. Les chercheurs étudieront bien entendu également les comportements sexuels des participants et la survenue d’autres infections sexuellement transmissibles.
Pour les personnes qui seraient infectées par le VIH dans l’étude, il sera observé attentivement le risque de développement de résistance du virus aux antirétroviraux utilisés et plus généralement l’évolution de leur infection en s’intéressant notamment aux éventuelles différences qui pourraient survenir du fait de l’utilisation préalable d’une PrEP.
Enfin, le projet de recherche comportera une étude économique destinée à évaluer le rapport entre le coût d’une PrEP (médicament, suivi médical, accompagnement préventif) et l’efficacité estimée de la technique en années de vie gagnée ou en qualité de vie gagnée.

23. La consultation communautaire menée par le groupe inter-associatif TRT-5 a fait l’objet d’un rapport remis aux investigateurs de l’essai et au directeur de l’ANRS, diffusé aux participants et disponible en ligne sur le site du groupe TRT-5.
2. L’essai iPrEx plus en détails
L’essai iPrEx démontre pour la première fois qu’une prise de TDF-FTC avant une exposition au virus permet de réduire le risque d’acquisition du VIH de 44% (intervalle de confiance : 15% à 63%) comparativement à des personnes suivies mais n’ayant pas reçu la molécule active.
Cet article propose un résumé de la méthodologie et des résultats de l’essai iPrEx, ainsi qu’une traduction des éléments de la discussion et des recommandations faites par les auteurs pour de futurs essais de PrEP.
3. Les essais IPERGAY et PROUD, les résultats
En janvier 2012, l’essai français IPERGAY inclut ses premiers volontaires. À l’automne, la FDA, l’autorité de santé américaine, annonce qu’elle approuve l’utilisation du Truvada en PrEP continue aux Etats-Unis. Face aux remises en causes de l’essai français suscitées par la nouvelle américaine, le comité scientifique de l’essai IPERGAY réaffirme l’importance du bras placebo pour valider l’étude. Communiqué.
En octobre 2014, à deux semaines d’intervalle, les phases de test des essais britanique PROUD et français IPERGAY sont interrompus pour cause d’efficacité prouvée ! Tous les participants reçoivent désormais la PrEP.
L’ANRS, promoteur de l’essai IPERGAY annonce : l’essai ANRS IPERGAY démontre l’efficacité d’un traitement préventif (une PrEP) contre l’infection par le VIH/sida lorsqu’il est pris au moment des rapports sexuels.
En février 2015 sont présentés les premiers résultats de la phase expérimentale de l’essai IPERGAY à la conférence américaine, la CROI en même temps que bon nombre d’autres données et résultats dont ceux de l’essai anglais PROUD :
>>> Résultats de l’essai de PrEP ANRS IPERGAY
>>> Résultats de l’essai de PrEP du MRC PROUD
4. PrEP, la recherche continue
4.1 PrEP : IPERGAY, PREVENIR, et après ?
(article du 25.11.2018)
L’usage de la PrEP se répand en France comme dans les autres pays. Les publications de bons résultats de son usage attestent de l’intérêt incontestable de cette méthode de prévention. C’est le cas en France avec l’étude PREVENIR. Si le standard international initial est celui d’une prise quotidienne d’antirétroviraux, le succès de l’essai français IPERGAY de PrEP permet à la proposition plus souple de PrEP « à la demande » de rentrer peu à peu dans les usages. Le point sur ces avancées.
4.2 Prévention 2.0 : PrEP, protectrice, mais jusqu’où ?
(article du 23.12.2018)
L’usage de la prophylaxie pré-exposition (PrEP) par une combinaison d’antrirétroviraux (emtricitabine et ténofovir) contre l’infection à VIH s’est répandu en France comme dans d’autres pays. L’intérêt incontestable de cette méthode de prévention est attesté dans de nombreuses publications. En 2017, deux cas d’infection par des virus résistants ont été rapportés malgré une utilisation adéquate de la PrEP. Une nouvelle publication rapporte un cas d’infection à VIH-1 de type sauvage (non résistant).
4.3 PrEP : l’étude PRÉVENIR a fait le plein
(article du 27.06.2019)
L’étude de suivi de la PrEP PRÉVENIR lancée en mai 2017 vient d’atteindre à deux ans les 3000 participants, son objectif.
Jusque là pas une seule contamination au VIH n’a été enregistrée dans l’étude
4.4 L’étude ANRS 174 Doxyvac
(article du 14.11.2019)
Proposée à 720 participants déjà inclus dans l’étude ANRS PRÉVENIR, cette étude a pour objectifs d’évaluer l’impact de 2 traitements préventifs sur le risque de survenue d’IST d’origine bactérienne.
Mais en faisant cela, nous constatons tout de même que notre communauté a un temps de retard. Des chercheurs sont venus nous proposer leurs idées dans le but d’apporter des solutions au fléau du sida qui nous frappe. Et nous tentons de réagir à leur proposition.
Si les forces de réflexion sur la prévention gay qui s’ébranlent avec l’arrivée de cet essai avaient existé avant, peut-être qu’au lieu de réagir à l’événement, nous aurions pu décider de ce que nous voulions et imposer notre agenda de recherche.
